题目内容
2.化学与生产、生活密切相关.下列叙述错误的是( )| A. | 大气中PM2.5比表面积大,吸附力强,能吸附许多有毒有害物质 | |
| B. | 在厨房里可用米汤检验加碘食盐中的碘 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| D. | 喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 |
分析 A.PM2.5表面积大,具有较强的吸附能力,能吸附大量的有毒、有害物质;
B.碘单质遇淀粉变蓝色,碘的化合物遇淀粉不变蓝色;
C.质子数相同中子数不同的同种元素的不同原子互称同位素;
D.能被人体吸收的铁元素是亚铁离子,容易被氧化,维生素C具有还原性,可以防止亚铁离子被氧化.
解答 解:A.PM2.5表面积大,具有较强的吸附能力,能吸附大量的有毒、有害物质,主要危害人体呼吸系统,故A正确;
B.米汤中含有淀粉,食盐中含有碘酸钾不含碘单质,碘酸钾遇淀粉不变蓝色,所以不能用米汤检验加碘食盐中的碘酸钾(KIO3),故B错误;
C.14C的应用主要有两个方面:一是在考古学中测定生物死亡年代,即放射性测年法,二是以14C标记化合物为示踪剂,12C和14C质子数相同中子数不同,互为同位素,故C正确;
D.能被人体吸收的铁元素是亚铁离子,亚铁离子很容易被氧化为三价铁离子,维生素C具有还原性,能将三价铁还原为亚铁离子,故D正确;
故选B.
点评 本题考查化学与生产、生活的关系,题目难度不大,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
12.可在有机物中引入羟基的反应类型( )
①取代、②加成、③消去、④酯化、⑤氧化、⑥还原.
①取代、②加成、③消去、④酯化、⑤氧化、⑥还原.
| A. | ①②③ | B. | ①②⑤⑥ | C. | ①④⑤⑥ | D. | ①②③⑥ |
13.某种只含Al、Fe、Cu的合金,称取a g样品,设计下列实验流程分析该合金的组成

下列相关叙述正确的是( )

下列相关叙述正确的是( )
| A. | 若向溶液F中加入K4[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液F中含有Fe2+ | |
| B. | 溶液N为深蓝色,说明溶液N中含大量Cu2+ | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
10.MnO2和锌是制造干电池的主要原料
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
[软锰矿、闪锌矿]$\stackrel{步骤①:硫酸}{→}$[滤液A]$\stackrel{步骤②:金属棒}{→}$[Zn2+、Mn2+、Fe2+、Al3+]$\stackrel{步骤③:物质C}{→}$
[ZnSO4、MnSO4溶液]$\stackrel{步骤④:电解}{→}$[Zn+MnO2+产品D]
已知各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
[软锰矿、闪锌矿]$\stackrel{步骤①:硫酸}{→}$[滤液A]$\stackrel{步骤②:金属棒}{→}$[Zn2+、Mn2+、Fe2+、Al3+]$\stackrel{步骤③:物质C}{→}$
[ZnSO4、MnSO4溶液]$\stackrel{步骤④:电解}{→}$[Zn+MnO2+产品D]
已知各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
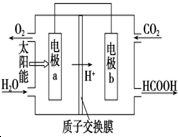
17. 利用微生物电池处理含乙酸钠和对氯酚
利用微生物电池处理含乙酸钠和对氯酚 的废水,工作原理如图所示.下列说法错误的是( )
的废水,工作原理如图所示.下列说法错误的是( )
 利用微生物电池处理含乙酸钠和对氯酚
利用微生物电池处理含乙酸钠和对氯酚 的废水,工作原理如图所示.下列说法错误的是( )
的废水,工作原理如图所示.下列说法错误的是( )| A. | 电极b是正极 | B. | 质子从b极移向a极 | ||
| C. | 处理后的废水pH降低 | D. | a极的电极反应式: +2e-+H+═ +2e-+H+═ +Cl- +Cl- |
14.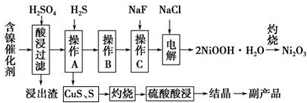 为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
已知常温下:①有关氢氧化物开始沉淀和沉淀完全
的pH如右表 ②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应式为Cl-+2OH--2e-=ClO-+H2O;
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
 为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
的pH如右表 ②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应式为Cl-+2OH--2e-=ClO-+H2O;
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
11.草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4•2H2O工艺流程如下: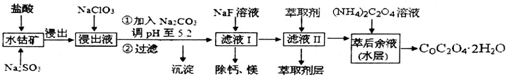
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是还原Fe3+、Co3+为Fe2+、Co2+.
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O?R(OH)3+3H+,向右移动,而产生氢氧化物沉淀
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
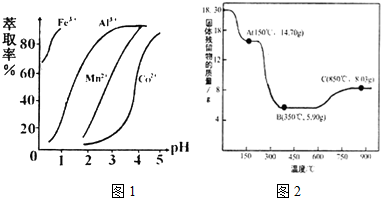
(5)萃取剂对金属离子的萃取率与pH的关系如1图所示,在滤液Ⅱ中适宜萃取的pH为3.0~3.5左右.
(6)已知:
NH3•H2O?NH4++OH- Kb=1.8×10-5
H2C2O4?H++H2CO4- K${\;}_{{a}_{1}}$=5.4×10-2
H2CO4-?H+C2O42- K${\;}_{{a}_{2}}$=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是Co3O4.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O?R(OH)3+3H+,向右移动,而产生氢氧化物沉淀
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
(5)萃取剂对金属离子的萃取率与pH的关系如1图所示,在滤液Ⅱ中适宜萃取的pH为3.0~3.5左右.

(6)已知:
NH3•H2O?NH4++OH- Kb=1.8×10-5
H2C2O4?H++H2CO4- K${\;}_{{a}_{1}}$=5.4×10-2
H2CO4-?H+C2O42- K${\;}_{{a}_{2}}$=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是Co3O4.
 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.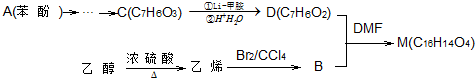
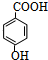

 .
.