题目内容
1.下列说法错误的是( )| A. | 各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7 | |
| B. | N原子的轨道表示式: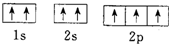 违反了泡利不相容原理 违反了泡利不相容原理 | |
| C. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 | |
| D. | 电子排布式(23V)1s22s22p63s23p63d34s2违反了洪特规则 |
分析 A.各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7;
B、泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子;
C、应选排能量低的4s轨道;
D、洪特规则:原子核外电子在能量相同的各个轨道上排布时①电子尽可能分占不同的原子轨道,②自旋状态相同,③全空、全满或半满时能量最低.
解答 解:A.各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7,s能级原子轨道呈球形,p能级原子轨道呈哑铃型,故A正确;
B、N原子的轨道表示式: 中1s和2s轨道中容纳自旋状态相同的电子,所以违反了泡利不相容原理,故B正确;
中1s和2s轨道中容纳自旋状态相同的电子,所以违反了泡利不相容原理,故B正确;
C、应选排能量低的4s轨道,而不是排能量高的3d,违反了能量最低原理,故C正确;
D、电子排布式(23V)1s22s22p63s23p63d34s2,符合能量最低原理、泡利不相容原理和洪特规则,故D错误;
故选D.
点评 本题考查了原子核外电子排布,领会能量最低原理、泡利不相容原理、洪特规则的内容来是答题的关键,难度不大.

练习册系列答案
相关题目
15.下列说法中正确的是( )
| A. | 无机含氧酸分子中的氧原子数越多,则其酸性也越强 | |
| B. | 氯化银能溶于过量的氨水.是因为它与氨水反应生成了一种可溶性的配位化合物 | |
| C. | 分子是否具有极性决定分子中是否存在极性共价键 | |
| D. | 氢键就是一种存在于某些特殊含氢元素的分子中的一种化学键 |
2.合成导电高分子化合物PPV的反应为:
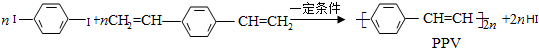
下列说法正确的是( )
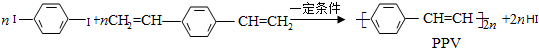
下列说法正确的是( )
| A. | PPV是聚苯乙炔 | |
| B. | 该反应为缩聚反应 | |
| C. | PPV与聚苯乙烯的最小结构单元组成相同 | |
| D. | 1 mol 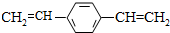 最多可与2 mol H2发生反应 最多可与2 mol H2发生反应 |
6.下列反应属于吸热反应的是( )
| A. | 氯化铵与消石灰反应 | B. | 酸碱中和反应 | ||
| C. | 铝热反应 | D. | 锌与盐酸反应 |
13.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 原子半径:Z>Y>X | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
11.“绿色化学”要求在化工合成过程中,目标产物对反应物的原子利用率达到100%,下列反应类型一定符合这一要求的是( )
| A. | 取代反应 | B. | 加成反应 | C. | 酯化反应 | D. | 氧化反应 |
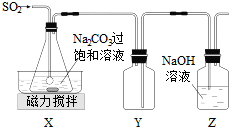
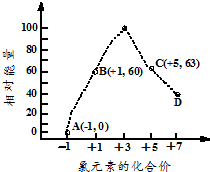 填写下列空白:
填写下列空白: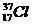 .
.