题目内容
某研究性学习小组对市场上的食用碘盐进行探究,他们选择“自然晶盐”作为研究对象.下表是“自然晶盐”包装袋上的有关说明:
(一)检验“自然晶盐”中是否含有碘
他们首先上网查阅了资料,搜索到“含碘盐中含有的碘酸钾(KIO3)在酸性条件下可以将KI中的碘离子氧化成碘单质,碘单质既是氧化产物又是还原产物”.
(1)在试管中加入少量“自然晶盐”溶液和KI溶液,然后滴入几滴稀H2SO4,最后再滴入 ,振荡试管,观察到 时,则说明该“自然晶盐”中含有碘元素,反应的化学方程式是 .
(2)实验后,他们在继续查阅资料时发现“空气中的氧气也能氧化I-,反应为4I-+O2+4H+=2I2+2H2O”,所以认为上述结论不严谨.于是小组经过讨论后决定,增加一个对照实验以排除氧气对上述实验的干扰.简述该对照实验的操作步骤: .
(二)测定“自然晶盐”的含碘量
依据反应I2+2S2O32-=2I-+S4O62-,该小组的实验步骤如下:
①称取5g食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
③以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol?L-1的Na2S2O3溶液5.0mL,恰好反应完全.
(3)判断步骤③中恰好完全反应的实验现象是: .
(4)根据以上实验数据,“自然晶盐”的碘含量为 mg/kg(精确到0.01),该食用碘盐 (填“合格”或“不合格”).
| 碘含量(以I计) | 符合(20~50)mg/kg的标准 |
| 配 料 | 天然海盐 碘酸钾 |
| 保 质 期 | 密封包装24个月 |
他们首先上网查阅了资料,搜索到“含碘盐中含有的碘酸钾(KIO3)在酸性条件下可以将KI中的碘离子氧化成碘单质,碘单质既是氧化产物又是还原产物”.
(1)在试管中加入少量“自然晶盐”溶液和KI溶液,然后滴入几滴稀H2SO4,最后再滴入
(2)实验后,他们在继续查阅资料时发现“空气中的氧气也能氧化I-,反应为4I-+O2+4H+=2I2+2H2O”,所以认为上述结论不严谨.于是小组经过讨论后决定,增加一个对照实验以排除氧气对上述实验的干扰.简述该对照实验的操作步骤:
(二)测定“自然晶盐”的含碘量
依据反应I2+2S2O32-=2I-+S4O62-,该小组的实验步骤如下:
①称取5g食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
③以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol?L-1的Na2S2O3溶液5.0mL,恰好反应完全.
(3)判断步骤③中恰好完全反应的实验现象是:
(4)根据以上实验数据,“自然晶盐”的碘含量为
考点:探究物质的组成或测量物质的含量,物质的检验和鉴别的实验方案设计
专题:实验探究和数据处理题
分析:(1)含碘盐中含有的碘酸钾(KIO3)在酸性条件下可以将KI中的碘离子氧化成碘单质,碘单质遇到淀粉变蓝;
(2)空气中的氧气也能氧化I-,反应为4I-+O2+4H+=2I2+2H2O”,增加一个对照实验以排除氧气对上述实验的干扰,可以在酸性碘化钾溶液中滴入淀粉,观察是否变蓝分析;
(3)KIO3与KI反应完全生成碘单质,以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol?L-1的Na2S2O3溶液5.0mL,蓝色变化为无色,且半分钟不变化证明反应达到终点;
(4)依据滴定反应定量关系计算碘元素质量计算分析;
(2)空气中的氧气也能氧化I-,反应为4I-+O2+4H+=2I2+2H2O”,增加一个对照实验以排除氧气对上述实验的干扰,可以在酸性碘化钾溶液中滴入淀粉,观察是否变蓝分析;
(3)KIO3与KI反应完全生成碘单质,以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol?L-1的Na2S2O3溶液5.0mL,蓝色变化为无色,且半分钟不变化证明反应达到终点;
(4)依据滴定反应定量关系计算碘元素质量计算分析;
解答:
解:(1)含碘盐中含有的碘酸钾(KIO3)在酸性条件下可以将KI中的碘离子氧化成碘单质,反应的化学方程式为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,碘单质遇到淀粉变蓝;
故答案为:淀粉试液,溶液变蓝,KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;
(2)空气中的氧气也能氧化I-,反应为4I-+O2+4H+=2I2+2H2O”,增加一个对照实验以排除氧气对上述实验的干扰,可以在酸性碘化钾溶液中滴入淀粉,观察是否变蓝设计,向一洁净试管中加入少量KI溶液,接着滴入几滴稀H2SO4,最后再滴入几滴淀粉试液,振荡试管,观察现象;
故答案为:向一洁净试管中加入少量KI溶液,接着滴入几滴稀H2SO4,最后再滴入几滴淀粉试液,振荡试管,观察现象;
(3)KIO3与KI反应完全生成碘单质,以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol?L-1的Na2S2O3溶液5.0mL,蓝色变化为无色,且半分钟不变化证明反应达到终点;
故答案为:溶液由蓝色刚好变为无色,且半分钟不变化;
(4)I2+2S2O32-=2I-+S4O62-,KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
KIO3~3I2 ~6S2O32-,
1 6
n 1.0×10-3mol?L-1×0.005L
n=
×10-6mol
,“自然晶盐”的碘含量=
×100%=21.17×10-6×100%×
=21.17mg/Kg,
符合(20~50)mg/kg的标准;
故答案为:21.17;合格;
故答案为:淀粉试液,溶液变蓝,KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;
(2)空气中的氧气也能氧化I-,反应为4I-+O2+4H+=2I2+2H2O”,增加一个对照实验以排除氧气对上述实验的干扰,可以在酸性碘化钾溶液中滴入淀粉,观察是否变蓝设计,向一洁净试管中加入少量KI溶液,接着滴入几滴稀H2SO4,最后再滴入几滴淀粉试液,振荡试管,观察现象;
故答案为:向一洁净试管中加入少量KI溶液,接着滴入几滴稀H2SO4,最后再滴入几滴淀粉试液,振荡试管,观察现象;
(3)KIO3与KI反应完全生成碘单质,以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol?L-1的Na2S2O3溶液5.0mL,蓝色变化为无色,且半分钟不变化证明反应达到终点;
故答案为:溶液由蓝色刚好变为无色,且半分钟不变化;
(4)I2+2S2O32-=2I-+S4O62-,KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
KIO3~3I2 ~6S2O32-,
1 6
n 1.0×10-3mol?L-1×0.005L
n=
| 5 |
| 6 |
,“自然晶盐”的碘含量=
| ||
| 5.0g |
| 103 |
| 10-3 |
符合(20~50)mg/kg的标准;
故答案为:21.17;合格;
点评:本题考查了物质组成的实验测定方法,滴定实验过程分析判断,反应原理的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如右图.下列叙述正确的是( )
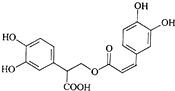

| A、迷迭香酸的所含官能团为:羟基、羧基、酯基和苯环 |
| B、1mol迷迭香酸最多能和8mol H2发生加成反应 |
| C、迷迭香酸可以发生水解反应、取代反应和酯化反应 |
| D、1mol迷迭香酸最多能和含5mol Br2单质完全反应 |
在配制一定物质的量浓度的硫酸溶液时,下列错误操作可使所配制溶液浓度偏高的是( )
| A、浓硫酸稀释后马上转移至容量瓶 |
| B、溶解搅拌时有液体飞溅 |
| C、容量瓶洗净后没有干燥 |
| D、定容时仰视容量瓶瓶颈刻度线 |
利用图示的四种实验装置进行下列实验:海水中提取水、从 KCl溶液中获取KCl晶体、分离CaCO3和水、分离植物油和水.其操作的名称依次是( )
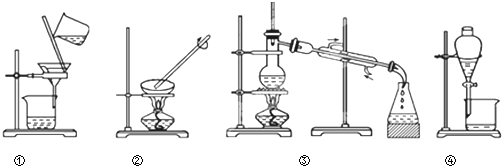

| A、蒸发、蒸馏、过滤、萃取 |
| B、过滤、蒸馏、蒸发、萃取 |
| C、过滤、蒸发、蒸馏、分液 |
| D、蒸馏、蒸发、过滤、分液 |
配制250mL 0.5mol/L NaOH溶液,下列仪器中:①托盘天平②量筒③烧杯④玻璃棒⑤漏斗⑥500mL容量瓶⑦药匙⑧250mL容量瓶⑨胶头滴管⑩坩埚,需要用到的仪器有( )
| A、①③④⑥⑨⑩ |
| B、①④⑦⑧⑨⑩ |
| C、①③④⑦⑧⑨ |
| D、①②④⑤⑧⑨ |
 用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸,其具体实验步骤如下:
用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸,其具体实验步骤如下: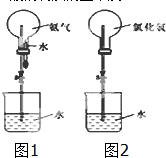 某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去).
某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去).