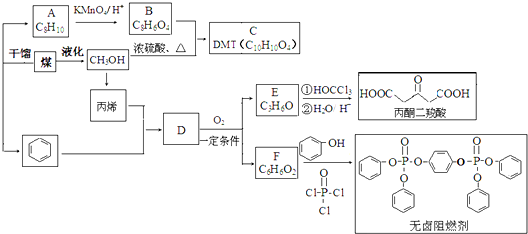
题目内容
配制250mL 0.5mol/L NaOH溶液,下列仪器中:①托盘天平②量筒③烧杯④玻璃棒⑤漏斗⑥500mL容量瓶⑦药匙⑧250mL容量瓶⑨胶头滴管⑩坩埚,需要用到的仪器有( )
| A、①③④⑥⑨⑩ |
| B、①④⑦⑧⑨⑩ |
| C、①③④⑦⑧⑨ |
| D、①②④⑤⑧⑨ |
考点:不能加热的仪器及使用方法
专题:
分析:配制250mL 0.5mol?L-1的NaOH溶液的步骤有:计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等,根据配制步骤选取使用的仪器,并根据仪器使用的先后顺序进行排序.
解答:
解:一定规格的容量瓶只能配制相应体积的溶液,容量瓶应选择250ml规格;
一般用托盘天平称量,用药匙取用药品,在烧杯中称量,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀.
所以需要的仪器及先后顺序为:托盘天平、烧杯、玻璃棒、药匙、筒量(可用、也可不用)、250mL容量瓶、胶头滴管,
即:①③④⑦⑧⑨,
故选C.
一般用托盘天平称量,用药匙取用药品,在烧杯中称量,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀.
所以需要的仪器及先后顺序为:托盘天平、烧杯、玻璃棒、药匙、筒量(可用、也可不用)、250mL容量瓶、胶头滴管,
即:①③④⑦⑧⑨,
故选C.
点评:本题考查了一定物质的量浓度溶液的配制,题目难度不大,注意掌握配制步骤,能够根据配制步骤判断使用的仪器的先后顺序,明确氢氧化钠易潮解,应在玻璃器皿中迅速称量.

练习册系列答案
相关题目
以下实验装置一般不用于分离物质的是( )
A、 |
B、 |
C、 |
D、 |
将铁、铝的混合物加入到足量氢氧化钠溶液中,充分反应后过滤,再将过滤得到的固体加入到足量的硫酸铜溶液中,充分反应后过滤得到的固体质量正好与原固体质量相等,则原固体中铝的质量分数为( )
| A、14.3% | B、12.5% |
| C、87.5% | D、无法计算 |
常温下可盛放浓硫酸的容器是( )
| A、Na | B、Zn | C、Al | D、Mg |
下列物质放置在空气中,不是因为发生氧化还原反应而变质的是( )
| A、Na |
| B、NaCl |
| C、NaOH |
| D、Na2O2 |
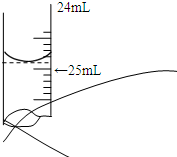 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题: