题目内容
20.写出下列反应的化学方程式①制漂白液的反应Cl2+2NaOH=NaCl+NaClO+H2O;
②用SiO2制备硅单质SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
分析 ①利用氯气与NaOH溶液反应制备漂白液;
②C还原二氧化硅制备粗硅.
解答 解:①制漂白液的反应为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
②用SiO2制备硅单质的反应为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
点评 本题考查物质的性质及化学反应方程式书写,为高频考点,把握反应物、生成物及质量守恒定律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
10.某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
回答下列问题:
(1)烧渣“酸溶”时发生反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、FeO+H2SO4=FeSO4+H2O.
(2)第一次过滤所产生的“滤渣”是SiO2(填化学式).
(3)加入FeS2还原后,检验Fe3+是否反应完全的试剂为KSCN溶液.
(4)所得FeCO3需充分洗涤,检验是否洗净的方法是取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净,反之,则说明没洗涤干净.“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是Fe(OH)3.
(5)①写出“还原”时反应Ⅱ的离子方程式:2Fe3++FeS2=3Fe2++2S↓.
②“还原”前后溶液中部分离子的浓度见下表(溶液体积变化或略不计):
则反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为7:3.
(6)第三次过滤所得到的“滤液”中大量存在的离子是NH4+、CO32-、SO42-(填离子符号)

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
回答下列问题:
(1)烧渣“酸溶”时发生反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、FeO+H2SO4=FeSO4+H2O.
(2)第一次过滤所产生的“滤渣”是SiO2(填化学式).
(3)加入FeS2还原后,检验Fe3+是否反应完全的试剂为KSCN溶液.
(4)所得FeCO3需充分洗涤,检验是否洗净的方法是取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净,反之,则说明没洗涤干净.“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是Fe(OH)3.
(5)①写出“还原”时反应Ⅱ的离子方程式:2Fe3++FeS2=3Fe2++2S↓.
②“还原”前后溶液中部分离子的浓度见下表(溶液体积变化或略不计):
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.5 |
| SO42- | 3.5 | 3.7 |
(6)第三次过滤所得到的“滤液”中大量存在的离子是NH4+、CO32-、SO42-(填离子符号)
11.下列关于乙烯的说法正确的是( )
| A. | 是天然气的主要成分 | B. | 不能使稀的酸性高锰酸钾溶液褪色 | ||
| C. | 是一种植物生长调节剂 | D. | 是聚乙烯塑料袋的主要成分 |
8.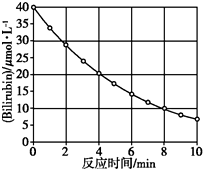 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )| A. | 2.5 μmol/( L•min)和2.0 μmol/L | B. | 2.5 μmol/( L•min)和2.5 μmol/L | ||
| C. | 3.0 μmol/( L•min)和3.0 μmol/L | D. | 5.0 μmol/( L•min)和3.0 μmol/L |
15.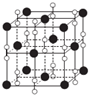 (1)已知KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的晶格能数据:
(1)已知KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的晶格能数据:
则该四种晶体(不包括NaCl)的熔点从高到低的顺序为TiN>MgO>CaO>KCl(以化学式表示).
(2)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构与NaCl相同(如图所示).据此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是pg•cm-3,则晶胞内最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρ•{N}_{A}}}$ cm(只要求列出算式,不必计算出数值结果,阿伏加德罗常数的值为NA).
 (1)已知KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的晶格能数据:
(1)已知KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的晶格能数据:| 晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
(2)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构与NaCl相同(如图所示).据此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是pg•cm-3,则晶胞内最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{72×4}{ρ•{N}_{A}}}$ cm(只要求列出算式,不必计算出数值结果,阿伏加德罗常数的值为NA).
9.下列实验中,对应的现象以及结论都正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 用洁淨铂丝蘸取少量待测液在酒精灯火焰上灼烧 | 火焰呈现黄色 | 待测液中只含Na+,不含K+ |
| B | 用铁作电极电解饱和食盐水 | 两极上均产生气体 | 阴、阳极分别生成H2和Cl2 |
| C | 向饱和氯水中加人少量石灰石 | 产生无色气体 | 酸性:HCl0>H2CO3 |
| D | 向Ca(ClO)2溶液中 通入足SO2 | 产生白色沉淀 | Ca(C1O)2具有氧化性,沉淀为CaSO4 |
| A. | A | B. | B | C. | C | D. | D |
2.Si、SiO2广泛用于制造晶体管、光导纤维等.下列有关说法正确的是( )
| A. | 附着油污的晶体管可用碱液浸泡 | B. | 光导纤维遇碱会影响光信号传输 | ||
| C. | 工业上用S iO2热分解法冶炼硅 | D. | 自然界中硅以游离态形式存在 |
 ):
):
 、F
、F .
. 、⑨
、⑨ .
.