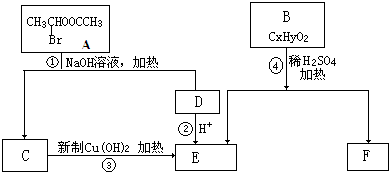
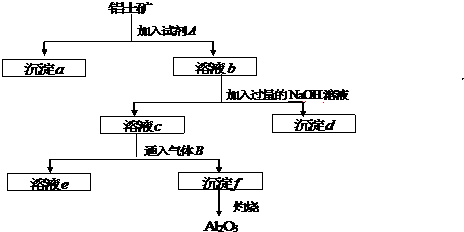
题目内容
下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:
(1)元素G在周期中的位置是 ;元素F所形成的常见单质的电子式为 .
(2)A、B、C、E的简单氢化物稳定性顺序是 (用化学式回答).
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是 .
(4)请写出B的单质的一种重要用途: ;工业上制取该单质的原理反应为 .
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | -2 | -4 | -2 | -3 | -1 | -3 | -4 | -1 |
(2)A、B、C、E的简单氢化物稳定性顺序是
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是
(4)请写出B的单质的一种重要用途:
考点:位置结构性质的相互关系应用,元素周期律和元素周期表的综合应用
专题:
分析:短周期元素,A、C的最低化合价-2,处于第ⅥA族,A最高化合价+6,且A原子半径较大,故A为S元素,C为O元素;B、G都有最高正价+4、最低负价-4,处于ⅣA族,B的原子半径较大,则B为Si、G为碳元素;D、F都有最高正价+5、最低负价-3,处于ⅤA族,D的原子半径较大,则F为P元素、F为N元素;E、H都有最低化合价-1,处于ⅦA族,H有最高正化合价+7,且原子半径较大,则E为F元素、H为Cl元素,以此来解答.
解答:
解:短周期元素,A、C的最低化合价-2,处于第ⅥA族,A最高化合价+6,且A原子半径较大,故A为S元素,C为O元素;B、G都有最高正价+4、最低负价-4,处于ⅣA族,B的原子半径较大,则B为Si、G为碳元素;D、F都有最高正价+5、最低负价-3,处于ⅤA族,D的原子半径较大,则F为P元素、F为N元素;E、H都有最低化合价-1,处于ⅦA族,H有最高正化合价+7,且原子半径较大,则E为F元素、H为Cl元素,
(1)G为碳元素,在周期中的位置是:第二周期ⅣA族;元素F所形成的常见单质为N2,其电子式为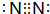 ,
,
故答案为:第二周期ⅣA族;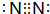 ;
;
(2)非金属性F>O>S>Si,则的氢化物稳定性顺序是HF>H2O>H2S>SiH4,
故答案为:HF>H2O>H2S>SiH4;
(3)SOCl2在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸,则生成SO2与HCl,该反应的化学方程式是SOCl2+H2O=SO2↑+2HCl,
故答案为:SOCl2+H2O=SO2↑+2HCl;
(4)硅单质可以用作半导体材料、制造合金、光电池等;工业上制取硅的反应为SiO2+2C
Si+2CO↑,
故答案为:用作半导体材料、制造合金、光电池等;SiO2+2C
Si+2CO↑.
(1)G为碳元素,在周期中的位置是:第二周期ⅣA族;元素F所形成的常见单质为N2,其电子式为
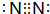 ,
,故答案为:第二周期ⅣA族;
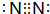 ;
;(2)非金属性F>O>S>Si,则的氢化物稳定性顺序是HF>H2O>H2S>SiH4,
故答案为:HF>H2O>H2S>SiH4;
(3)SOCl2在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸,则生成SO2与HCl,该反应的化学方程式是SOCl2+H2O=SO2↑+2HCl,
故答案为:SOCl2+H2O=SO2↑+2HCl;
(4)硅单质可以用作半导体材料、制造合金、光电池等;工业上制取硅的反应为SiO2+2C
| ||
故答案为:用作半导体材料、制造合金、光电池等;SiO2+2C
| ||
点评:本题考查性质结构位置关系应用,为高频考点,涉及电子式及化学方程式等常用化学用语、元素周期律等,题目难度中等,注意利用化合价与半径确定元素是解题关键.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
下列有关实验原理或实验操作结论正确的是( )
| A、配制酸性KMnO4溶液时,用盐酸酸化 |
| B、用水湿润pH试纸测量某溶液的pH值 |
C、实验室用右图所示装置除去Cl2中的少量HCl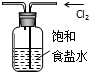 |
| D、用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
洋蓟属高档蔬菜,从洋蓟提取的物质A具有良好的保健功能和药用价值,A在酸性条件下水解可生成B和C,反应可表示为下列说法不正确的是( )
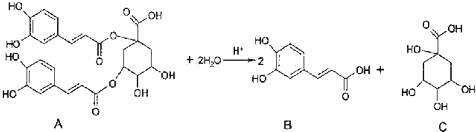

| A、A在一定条件下能发生取代反应、加成反应和消去反应 |
| B、1mol A和足量NaOH溶液反应,最多消耗11molNaOH |
| C、B能和浓溴水发生反应,1mol B最多消耗4 molBr2 |
| D、C分子中含有手性碳原子 |
常温下,下列各组粒子在指定体系中一定能大量共存的是( )
| A、遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、H2O2 |
| B、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、Fe3+ |
| C、使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- |
| D、0.1mol?L-1 NaHCO3溶液:K+、AlO2-、Cl-、NO3- |
一定温度下,下列溶液的离子浓度关系式正确的是( )
| A、pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | ||
| B、pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol?L-1 | ||
| C、pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | ||
D、pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O
|