题目内容
甲醇是一种重要的化工原料.
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1
②H2O(l)=H2O(g)△H=+44.0kJ?mol-1写出表示甲醇燃烧热的热化学方程式 .
(2)甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
CH3OH (g)+H2O (g)?CO2(g)+3H2(g)△H=-72.0kJ/mol
①该反应的平衡常数表达式为 .
②下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选) .
A.加入催化剂
B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离
D.恒容再充入1molH2O(g)
(3)甲醇可以氧化成甲酸,在常温下用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH) (填“<”或“>”或“=”) 20.00mL.
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1
②H2O(l)=H2O(g)△H=+44.0kJ?mol-1写出表示甲醇燃烧热的热化学方程式
(2)甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
CH3OH (g)+H2O (g)?CO2(g)+3H2(g)△H=-72.0kJ/mol
①该反应的平衡常数表达式为
②下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)
A.加入催化剂
B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离
D.恒容再充入1molH2O(g)
(3)甲醇可以氧化成甲酸,在常温下用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)
考点:用盖斯定律进行有关反应热的计算,化学方程式的有关计算,化学平衡的影响因素
专题:
分析:(1)根据盖斯定律来解答;
(2)①依据平衡常数概念书写反应的平衡常数表达式;
②为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量;
(3)NaOH和甲酸恰好反应时生成强碱弱酸盐,溶液呈碱性,若要呈中性,则甲酸过量.
(2)①依据平衡常数概念书写反应的平衡常数表达式;
②为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量;
(3)NaOH和甲酸恰好反应时生成强碱弱酸盐,溶液呈碱性,若要呈中性,则甲酸过量.
解答:
解:(1)根据盖斯定律,将①-②×4可得:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=(-1275.6kJ/mol)-(+44.0kJ/mol)×4=-1451.6kJ/mol,所以表示甲醇燃烧热的热化学方程式为:CH3OH(l)+3/2 O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,
故答案为:CH3OH(l)+3/2 O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
(2)①CH3OH (g)+H2O (g)?CO2(g)+3H2(g)△H=-72.0kJ/mol,该反应的平衡常数表达式为K=
,故答案为:
;
②CH3OH (g)+H2O (g)?CO2(g)+3H2(g),反应是气体体积增大的反应;
A、加入催化剂,平衡向不发生移动,甲醇与二氧化碳的物质的量比值不变,故A错误;
B、恒容充入He(g),使体系压强增大,分压不变,对反应物质没有影响,平衡不移动,二者比值不变,故B错误;
C、将H2(g)从体系中分离,生成物的浓度减小,平衡向正反应方向移动,二者比值变大,故C正确;
D、再充入1mol H2O,平衡向正方向移动,甲醇浓度增大,二者比值增大,故D正确.
故答案为:CD;
(3)NaOH和甲酸恰好反应时生成强碱弱酸盐,溶液呈碱性,若要呈中性,则甲酸过,所以滴定到pH=7时,V(NaOH)<20.00ml,故答案为:<.
故答案为:CH3OH(l)+3/2 O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
(2)①CH3OH (g)+H2O (g)?CO2(g)+3H2(g)△H=-72.0kJ/mol,该反应的平衡常数表达式为K=
| C(CO 2)C(H 2)3 |
| C(CH 3OH)C(H 2O) |
| C(CO 2)C(H 2)3 |
| C(CH 3OH)C(H 2O) |
②CH3OH (g)+H2O (g)?CO2(g)+3H2(g),反应是气体体积增大的反应;
A、加入催化剂,平衡向不发生移动,甲醇与二氧化碳的物质的量比值不变,故A错误;
B、恒容充入He(g),使体系压强增大,分压不变,对反应物质没有影响,平衡不移动,二者比值不变,故B错误;
C、将H2(g)从体系中分离,生成物的浓度减小,平衡向正反应方向移动,二者比值变大,故C正确;
D、再充入1mol H2O,平衡向正方向移动,甲醇浓度增大,二者比值增大,故D正确.
故答案为:CD;
(3)NaOH和甲酸恰好反应时生成强碱弱酸盐,溶液呈碱性,若要呈中性,则甲酸过,所以滴定到pH=7时,V(NaOH)<20.00ml,故答案为:<.
点评:本题考查了盖斯定律、化学平衡移动原理及其中和滴定的判断,难度中等.

练习册系列答案
相关题目
下列说法中,不正确的是( )
| A、在其他条件不变时,对于反应2SO2(g)+O2(g)?2SO3(g)起始SO2与 O2按1:1的投料比加入,反应达到平衡后,若继续通入SO2,反应重新达平衡后,则SO3体积分数增大 |
| B、因常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)很容易进行,故该反应的△H<0 |
| C、在其他条件不变时,向H2(g)+I2(g)?2HI(g)平衡体系中加催化剂,反应速率加快,I2转化率不变 |
| D、14CO2与碳在高温条件下发生反应:CO2+C?2CO达到化学平衡后,平衡混合物中含14C的微粒有CO2、C、CO |
下列平衡体系中,升温或减压都能使平衡向正反应方向移动的是(△H<0表示放热)( )
| A、N2(g)+3H2(g)?2NH3(g)△H<0 |
| B、N2(g)+O2(g)?2NO(g)△H<0 |
| C、C(s)+2H2O(g)?CO2(g)+2H2(g)△H>0 |
| D、2SO2(g)+O2(g)?2SO3(g)△H<0 |
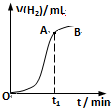 某学生用质量为a g,边长为b cm的正方形镀锌铁片与过量盐酸反应测定锌镀层的厚度,并将实验结果绘成曲线图.反应完毕铁片的质量为c g(已知锌的密度为ρ g/cm3).下列叙述错误的是( )
某学生用质量为a g,边长为b cm的正方形镀锌铁片与过量盐酸反应测定锌镀层的厚度,并将实验结果绘成曲线图.反应完毕铁片的质量为c g(已知锌的密度为ρ g/cm3).下列叙述错误的是( )| A、t1时刻锌镀层已完全反应 | ||
B、锌镀层的厚度为
| ||
| C、反应放热也是影响OA段反应速率的因素之一 | ||
| D、烘干时间过长,会导致测定结果偏小 |
下列热化学方程式表达正确的是(△H的绝对值均正确)( )
| A、C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) |
| B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=+57.3kJ/mol(中和热) |
| C、S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol (反应热) |
| D、2NO2=O2+2NO△H=+116.2kJ/mol (反应热) |
我们学习化学很重要的一个方面就是解决生活中的实际问题,下列家庭小实验不合理的是( )
| A、用灼烧并闻气味的方法检验真皮衣料 |
| B、用淀粉和水检验食盐中的碘元素 |
| C、用食用碱(Na2CO3)溶液洗涤餐具上的油污 |
| D、用食醋除去热水壶中的水垢 |
下列各组物质相互反应时,改变反应的条件或者反应物的物质的量之比,生成的产物不变的是( )
| A、Na与氧气 |
| B、澄清石灰水与二氧化碳 |
| C、KHCO3与Ba(OH)2 |
| D、Al与稀盐酸 |