题目内容
16.明矾水溶液呈酸性,原因是Al3++3H2O?Al(OH)3+3H+;小苏打水溶液呈碱性,原因是HCO3-+H2O?H2CO3+OH-.把上述两溶液混合后呈现的现象有有白色沉淀产生和无色气体放出,反应现象的离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑.分析 盐溶液中有弱才水解,明矾是硫酸铝钾,水溶液中溶解后,铝离子是弱碱阳离子,水溶液中水解溶液显酸性,小苏打是碳酸氢钠,溶液中碳酸氢根离子是弱酸阴离子,水溶液中水解显碱性,明矾和碳酸氢钠溶液混合,二者水解相互促进反应进行彻底生成氢氧化铝沉淀和二氧化碳气体;
解答 解:明矾是硫酸铝钾,水溶液中溶解后,铝离子是弱碱阳离子,水溶液中水解溶液显酸性,Al3++3H2O?Al(OH)3+3H+,小苏打是碳酸氢钠,溶液中碳酸氢根离子是弱酸阴离子,水溶液中水解显碱性,水解离子方程式为:HCO3-+H2O?H2CO3+OH-,明矾和碳酸氢钠溶液混合,二者水解相互促进反应进行彻底生成氢氧化铝沉淀和二氧化碳气体,反应现象为:有白色沉淀产生和无色气体放出,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:酸;Al3++3H2O?Al(OH)3+3H+;碱;HCO3-+H2O?H2CO3+OH-;有白色沉淀产生和无色气体放出;Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评 本题考查了盐类水解的原理,离子方程式书写,水解相互促进的反应进行彻底生成沉淀和气体,离子方程式书写用等号,需要标注沉淀和气体,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列实验室保存化学试剂的方法中,因试剂与容器反应而选用不当的是( )
| A. |  硫磺颗粒 | B. |  浓硝酸 | C. |  硫酸钠溶液 | D. |  硝酸银溶液 |
4.氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
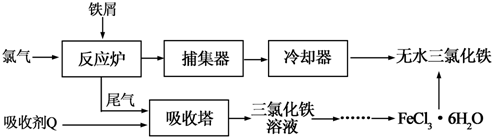
(1)试写出吸收塔中吸收剂Q反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(2)六水合氯化铁在水中的溶解度如下:
从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入少量盐酸、加热浓缩;、冷却结晶、过滤、洗涤、干燥.再由FeCl3•6H2O晶体得到无水FeCl3的操作是:在氯化氢气流中加热FeCl3•6H2O晶体,得到无水FeCl3.
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=4×10-8mol•L-1.(常温下Ksp[Fe(OH)3]=4×10-38).
(4)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式SO2+2H2O+2Fe3+=2Fe2++4H++SO42-.
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式Fe(OH)3.请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释Fe3+会水解产生较多的H+:Fe3++3H2O?Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀.

(1)试写出吸收塔中吸收剂Q反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(2)六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=4×10-8mol•L-1.(常温下Ksp[Fe(OH)3]=4×10-38).
(4)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式SO2+2H2O+2Fe3+=2Fe2++4H++SO42-.
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式Fe(OH)3.请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释Fe3+会水解产生较多的H+:Fe3++3H2O?Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀.
11.常温下,将pH=2的酸溶液和pH=12的苛性钠溶液等体积混合后,则溶液中( )
| A. | pH=7 | B. | pH≥7 | C. | pH≤7 | D. | C(H+)•C(OH-)=10-14 |
6.下列说法正确的是( )
| A. | 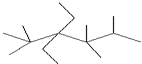 的系统命名为2,2,4,4,5-五甲基-3-二乙基己烷 的系统命名为2,2,4,4,5-五甲基-3-二乙基己烷 | |
| B. | 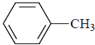 能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂 能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂 | |
| C. | 等物质的量的乙烯和乙醇的耗氧量相同 | |
| D. | 石油的分馏和煤的干馏都是物理变化 |
 .
. .
.