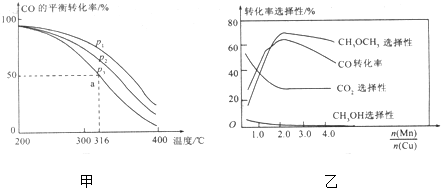
题目内容
18.反应aA (g)+bB (g)?cC(g)建立的平衡体系如图表示,则下列说法正确的是( )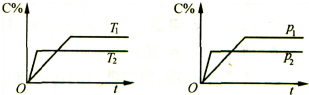
| A. | Tl>T2,△H<O | B. | Tl<T2,△H<O | C. | Pl>P2,a+b>c | D. | Pl<P2,a+b>c |
分析 由图可知,压强P2先到达平衡,则压强P2>P1,压强越大,C的百分含量减小,说明增大压强平衡向逆反应方向移动;温度T1先到达平衡,故温度T1<T2,温度越高,平衡时C的含量越低,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应,据此分析解答.
解答 解:由图可知,压强P2先到达平衡,则压强P2>P1,压强越大,C的百分含量减小,说明增大压强平衡向逆反应方向移动,所以逆方向是气体的系数和减小的方向,a+b<c;温度T1先到达平衡,故温度T1<T2,温度越高,平衡时C的含量越低,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应△H<O,故选B.
点评 本题考查化学平衡图象及影响因素,难度中等,注意采取控制变量法与“先拐先平数值大”原则分析解答.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
9.下列各组物质中,能用高锰酸钾酸性溶液鉴别的是( )
| A. | 乙烯、乙炔 | B. | 1-己烯、甲苯 | C. | 苯、正己烷 | D. | 丙烷 丙炔 |
6.下列物质(或主要成分)对应的化学式中,不正确的是( )
| A. | 小苏打NaHCO3 | B. | 烧碱NaOH | C. | 绿矾FeSO4•7H2O | D. | 钡餐BaCO3 |
13.测定硫酸铜晶体(CuSO4•xH2O)中x值的实验过程如下.完成下列填空:
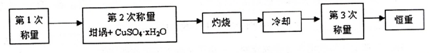
(1)设待测硫酸铜晶体的化学式为CuSO4•xH2O,则该硫酸铜晶体受热失去全部结晶水的化学方程式为CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O.

a.研钵 b.镊子 c.坩埚 d.三角架
(2)下列是实验中用到的几种仪器,仪器与对应名称正确的是ac.(填序号)
(3)“冷却”操作应在干燥器(填仪器名称)中进行,“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是酒精喷灯温度太高,容易使CuSO4受热分解.
(4)恒重操作的目的是确保硫酸铜晶体失水完全.
(5)测定硫酸铜晶体结晶水含量时,若实验结果偏低,原因可能是d.(填序号)
a.坩埚未完全干燥b.加热过程中晶体有少量溅失
c.坩埚上沾有受热不分解的杂质d.加热后未放入干燥器中冷却
(6)下面是某学生实验的一次数据,请完成计算
(1)若无需再进行第三次称量,则a的数值范围应为18.630-18.632.
(2)若加热后坩埚与固体总质量为18.631g,实测值x=5.22(保留两位小数)
(3)若理论值x=5,则该实验的相对误差是4.4%.

(1)设待测硫酸铜晶体的化学式为CuSO4•xH2O,则该硫酸铜晶体受热失去全部结晶水的化学方程式为CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O.

a.研钵 b.镊子 c.坩埚 d.三角架
(2)下列是实验中用到的几种仪器,仪器与对应名称正确的是ac.(填序号)
(3)“冷却”操作应在干燥器(填仪器名称)中进行,“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是酒精喷灯温度太高,容易使CuSO4受热分解.
(4)恒重操作的目的是确保硫酸铜晶体失水完全.
(5)测定硫酸铜晶体结晶水含量时,若实验结果偏低,原因可能是d.(填序号)
a.坩埚未完全干燥b.加热过程中晶体有少量溅失
c.坩埚上沾有受热不分解的杂质d.加热后未放入干燥器中冷却
(6)下面是某学生实验的一次数据,请完成计算
| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 11.721g | 22.692g | 18.631g | a |
(2)若加热后坩埚与固体总质量为18.631g,实测值x=5.22(保留两位小数)
(3)若理论值x=5,则该实验的相对误差是4.4%.
3.下列有关电解的说法正确的是( )
| A. | 惰性电极电解硝酸银溶液不可能在电极上生成银,因为银可以溶于硝酸 | |
| B. | 25℃,惰性电极电解氢氧化钠溶液,溶液PH不变,因为实质是电解水 | |
| C. | 惰性电极电解足量硫酸铜溶液一段时间加入氧化铜固体可使电解质恢复到电解前 | |
| D. | 惰性电极电解淀粉碘化钾溶液,可看到阴极区域溶液变蓝 |
10.下列有关实验的操作,原理和现象的叙述不正确的是( )
| A. | 向AlCl3溶液中滴加氨水,会产生白色沉淀,再加入NaHSO4,沉淀不消失 | |
| B. | 浓的NaOH溶液不慎溅到皮肤上,可无用大量水冲洗,再涂上硼酸或稀醋酸溶液 | |
| C. | AlCl3溶液中加入过量NaF固体,再滴加氨水,无沉淀产生说明[AlF6]3-很难电离 | |
| D. | 检验Cl-时,为了排除SO42-的干扰,可先滴加过量的Ba(NO3)2溶液后,取上层溶液,再滴加AgNO3溶液,若有白色沉淀,则表明原溶液中有Cl-存在 |
7.热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
| A. | 每转移0.1mol电子,理论上生成20.7g Pb | |
| B. | 常温时,在正负极间接上电流表或检流计,指针不偏转 | |
| C. | 正极反应式:Pb2++2e-═Pb | |
| D. | 放电过程中,Li+向负极移动 |