题目内容
9.用NA表示阿伏伽德罗常数的值,下列说法不正确的是( )| A. | 28gCO与N2的混合物中含有的分子总数为NA | |
| B. | 常温、常压下,22.4LO2中含有的O2分子数为NA | |
| C. | 1L1mol•L-1K2SO4溶液中含有的钾离子数为2NA | |
| D. | 过量的铁1molCl2充分反应时,铁失去的电子数为2NA |
分析 A.一氧化碳和氮气的摩尔质量都是28g/mol,28g混合物的物质的量为1mol;
B.Vm在标准状况下为22.4L/mol,常温常压下气体摩尔体积Vm不知道;
C.1molK2SO4电离生成2mol钾离子;
D.1molCl2与足量的铁反应,电子转移依据氯气计算.
解答 解:A.28g氮气和一氧化碳的物质的量为1mol,1mol混合物中含有1mol气体分子,含有的分子总数为NA,故A正确;
B.Vm在标准状况下为22.4L/mol,常温常压下气体摩尔体积Vm不知道,因此无法求出常温常压下22.4LO2的物质的量,分子数也无法求出,故B错误;
C.1L1mol•L-1K2SO4溶液中含有的钾离子数为2NA,故C正确;
D.1molCl2与足量的铁反应,电子转移依据氯气计算,电子转移为2mol,电子数为N=n×NA=2×NA=2NA,故D正确.
故选B.
点评 本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列实验装置(部分固定装置略去)和有关叙述正确的是( )
| A. | 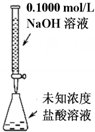 可以进行酸碱中和滴定实验 | |
| B. | 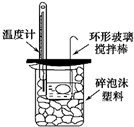 可以进行中和热的测定实验 | |
| C. | 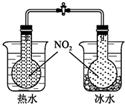 可验证温度对化学平衡的影响 | |
| D. | 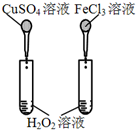 比较Cu2+、Fe3+对H2O2分解速率的影响 |
20.SF6分子结构中只存在S-F键,是优良的绝缘气体,制备原理如下:S(s)+3F2(g)→SF6(g)△H=?;已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F-F、S-F键需吸收的能量分别为160kJ、330kJ.则△H的值为(单位:kJ?mol-1)( )
| A. | 1780 | B. | 1220 | C. | -1220 | D. | -1780 |
17.下列说法正确的是( )
| A. | 分子式C7H16的烃,分子中有4个甲基的同分异构体有4种(不考虑立体异构) | |
| B. | 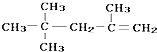 的名称为:2,2,4-三甲基-4-戊烯 的名称为:2,2,4-三甲基-4-戊烯 | |
| C. | 化合物 是苯的同系物 是苯的同系物 | |
| D. | 苯和溴水在三溴化铁做催化剂的条件下发生取代反应 |
4.升高温度,下列常数中不一定增大的是( )
| A. | 电离常数Ka | B. | 化学平衡常数K | ||
| C. | 水的离子积常数Kw | D. | 盐的水解常数Kh |
18.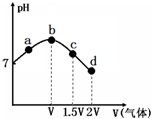 常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发).下列叙述不正确的是( )
常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发).下列叙述不正确的是( )
 常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发).下列叙述不正确的是( )
常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发).下列叙述不正确的是( )| A. | 由a点到b点的过程中,溶液中$\frac{{c(N{H_3}•{H_2}O)}}{c(NH_4^+)}$增大 | |
| B. | 由图可知(NH4)2CO3溶液显碱性、NH4Cl溶液显酸性 | |
| C. | c点所示溶液中,c(NH4+)>c(CO32-)>c(OH-)>c(H+) | |
| D. | d点所示溶液中,c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) |
 (1)铝热反应在工业生产中的重要用途之一是焊接钢轨或冶炼难熔金属等;用化学方程式表示出其中的原理2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe(举一例).铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸、碱破坏,若将表面有一层氧化铝薄膜的铝条和氢氧化钠溶液作用,反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(1)铝热反应在工业生产中的重要用途之一是焊接钢轨或冶炼难熔金属等;用化学方程式表示出其中的原理2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe(举一例).铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸、碱破坏,若将表面有一层氧化铝薄膜的铝条和氢氧化钠溶液作用,反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
 中含有手性碳原子数2个.用“*”对应的碳原子.
中含有手性碳原子数2个.用“*”对应的碳原子.