题目内容
17.胶体区别于其他分散系的根本原因是( )| A. | 胶体粒子带电 | B. | 胶体粒子不可穿过半透膜 | ||
| C. | 分散质粒子直径在1~100 nm之间 | D. | 胶体有丁达尔现象 |
分析 分散系的本质区别在于分散质微粒的直径大小,溶液中分散质粒径一般小于1 nm,胶体中分散质粒径一般为1~100 nm,浊液的粒子直径大于100nm,胶体区别于其他分散系的根本原因是分散质粒子直径在1~100 nm之间.
解答 解:胶体区别于其它分散系的本质特征是胶体粒子直径在1-100nm之间,溶液的分散质微粒的直径小于1nm,浊液的分散质微粒的直径大于100nm.
故选C.
点评 本题考查了胶体的本质特征,胶体区别于其他分散系的本质特征是分散质微粒直径的大小不同,题目难度不大.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 胶体区别于其他分散系的本质特征是胶体可发生丁达尔效应 | |
| B. | 在一定温度和压强下,气体体积主要取决于气体分子之间的平均间距 | |
| C. | 摩尔质量与物质的量的多少有关,它等于物质的质量除以物质的量 | |
| D. | 确定物质中是否含有C、H、O、N、Cl、Br、S等元素可用元素分析仪,确定物质中是否含有哪些金属元素可用原子吸收光谱 |
8.下列有关物质的分类或归类中正确的是( )
①混合物:福尔马林、水玻璃、水银
②化合物:CaCl2、烧碱、聚苯乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡
④同位素:${\;}_{6}^{12}C$、${\;}_{6}^{13}C$、${\;}_{6}^{14}C$.
①混合物:福尔马林、水玻璃、水银
②化合物:CaCl2、烧碱、聚苯乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡
④同位素:${\;}_{6}^{12}C$、${\;}_{6}^{13}C$、${\;}_{6}^{14}C$.
| A. | ①③ | B. | ②③ | C. | ③④ | D. | ②④ |
5.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知H2(g)+Cl2(g)═2HCl(g)△H=-185kJ/mol,则氢气的燃烧热为185 kJ/mol | |
| B. | 已知石墨比金刚石稳定,则C (石墨,s)═C(金刚石,s)△H<0 | |
| C. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 | |
| D. | 已知Ni(CO)4(s)═Ni(s)+4CO(g)△H=+Q kJ•mol-1,则Ni(s)+4CO(g)═Ni(CO)4(s)△H=-Q kJ•mol-1 |
12.下列各组分子、离子在指定溶液中一定能大量共存的是( )
| A. | 含Fe3+的溶液中: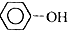 、Na+、NO3-、SO42- 、Na+、NO3-、SO42- | |
| B. | pH=13的溶液中:Na+、K+、S2-、SO32- | |
| C. | 能使淀粉KI试纸显蓝色的溶液中:NH4+、Fe2+、NO3-、Cl- | |
| D. | 在水电离的c(OH-)=10-13mol/L的溶液中:Na+、Ba2+、ClO-、NH4+ |
2.阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是( )
| A. | 1.01×105Pa、25℃时,2.24LCl2中含有的原子数为0.2×6.02×1023 | |
| B. | 0.1L、3mol•L-1NH4NO3溶液中含有的N原子数目为0.3×6.02×1023 | |
| C. | 5.6g铁粉与足量CuSO4溶液反应生成的铜原子数为0.2×6.02×1023 | |
| D. | 46 g NO2和N2O4的混合物中含有的原子数为3×6.02×1023 |
9.下列有关物质的分类一定正确的是( )
| A. | 强电解质:纯碱、明矾、石墨 | B. | 弱电解质:硅酸、氨水、氢氧化铜 | ||
| C. | 非电解质:液氨、三氧化硫、蔗糖 | D. | 同系物:CH2O2、C2H4O2、C3H6O2 |
6.通过以下反应均可获取H2.下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=+131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.1kJ•mol-1.
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=+131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.1kJ•mol-1.
| A. | 反应CH4(g)═C(s)+2 H2(g)的△H4=+74.8kJ•mol-1 | |
| B. | 反应①中电能转化为化学能 | |
| C. | 反应②中反应物的总能量高于生成物的总能量 | |
| D. | 反应③使用催化剂,△H3减小 |
