题目内容
12.下列各组分子、离子在指定溶液中一定能大量共存的是( )| A. | 含Fe3+的溶液中: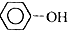 、Na+、NO3-、SO42- 、Na+、NO3-、SO42- | |
| B. | pH=13的溶液中:Na+、K+、S2-、SO32- | |
| C. | 能使淀粉KI试纸显蓝色的溶液中:NH4+、Fe2+、NO3-、Cl- | |
| D. | 在水电离的c(OH-)=10-13mol/L的溶液中:Na+、Ba2+、ClO-、NH4+ |
分析 A.铁离子与苯酚发生颜色反应;
B.该溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.该溶液具有氧化性,能够氧化亚铁离子;
D.该溶液中存在大量氢离子或氢氧根离子,次氯酸根离子与氢离子反应,铵根离子与氢氧根离子反应.
解答 解:A.Fe3+与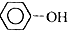 发生反应,在溶液中不能大量共存,故A错误;
发生反应,在溶液中不能大量共存,故A错误;
B.pH=13的溶液中存在大量氢氧根离子,Na+、K+、S2-、SO32-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.能使淀粉KI试纸显蓝色的溶液具有氧化性,能够氧化Fe2+,在溶液中不能大量共存,故C错误;
D.在水电离的c(OH-)=10-13mol/L的溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,ClO-与氢离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
2.离子反应是一类重要反应,还原性Fe2+>Br-,下列有关离子方程式书写正确的是( )
| A. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | Mg(OH)2与H2SO4反应:Mg2++2OH-+2H++SO42═MgSO4↓+2H2O | |
| C. | 向硫酸氢钠溶液加氢氧化钡溶液至完全沉淀:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| D. | FeBr2溶液与Cl2按照等物质的量反应:2Br-+Cl2═2Cl-+Br2 |
20.在实验室中,对下来事故或药品的处理正确的是( )
| A. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| B. | 未使用完的白磷要随时收集起来,并与空气隔绝 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 含硫酸的废液倒入水槽,用水冲入下水道 |
7.1g O2和1g O3相比,下列表述正确的是( )
| A. | 所含分子数相同 | B. | 1g O3中所含分子数较多 | ||
| C. | 所含原子数不同 | D. | 所含原子数相同 |
17.胶体区别于其他分散系的根本原因是( )
| A. | 胶体粒子带电 | B. | 胶体粒子不可穿过半透膜 | ||
| C. | 分散质粒子直径在1~100 nm之间 | D. | 胶体有丁达尔现象 |
1.下列镁的化合物中,能与稀盐酸反应并生成无色有刺激性气味气体的是( )
| A. | MgO | B. | MgCO3 | C. | Mg2(OH)2CO3 | D. | Mg3N2 |
2.下列说法不正确的是( )
| A. | 在化学反应中,伴随着物质的变化,既有化学键的断裂又有化学键的形成,还有化学能的改变 | |
| B. | 在化学反应过程中是放出热量还是吸收热量,取决于反应物总能量与生成物总能量的相对大小 | |
| C. | 需要加热的化学反应,该化学反应过程一定是吸收能量 | |
| D. | 物质具有的能量越低,其稳定性越大,反应越难以发生;物质具有的能量越高,其稳定性越小,反应越容易发生 |
 如图是某硫酸试剂瓶标签上的内容:
如图是某硫酸试剂瓶标签上的内容: