题目内容
3.取一定质量镁铝合金,溶于足量盐酸,加过量NaOH溶液,滤出沉淀,加强热灼烧,得白色粉末,干燥后称量,这些粉末与原合金质量相等,则原合金中铝的质量分数为( )| A. | 30% | B. | 40% | C. | 60% | D. | 70% |
分析 镁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,沉淀为氢氧化镁,则经洗涤、干燥、灼烧,得到白色粉末为氧化镁,氧化镁质量等于合金的质量,利用组成可知氧化镁中O元素的质量等于合金中Al的质量,以此来解答.
解答 解:由镁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,沉淀为氢氧化镁,则经洗涤、干燥、灼烧,得到白色粉末为MgO,MgO的质量等于合金Mg、Al的质量,所以MgO中O元素的质量等于合金中Al的质量,即$\frac{16}{40}$×100%=40%,
故选B.
点评 本题考查混合物的有关计算,题目难度中等,明确发生的反应找出合金与氧化物的关系是解答本题的关键,试题侧重考查学生的分析、理解能力.

练习册系列答案
相关题目
18.下列反应中氯元素全部被还原的是( )
| A. | 5Cl2+I2+6H2O═10HCl+2HIO3 | |
| B. | 2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)+2H2O | |
| C. | MnO2+4HCI$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | 2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH++Cl2↑+H2↑ |
8.利尿酸在奥运会上被禁用,其结构简式如图所示.下列叙述正确的是( )
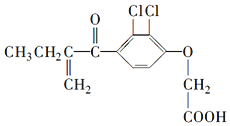

| A. | 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4 | |
| B. | 利尿酸分子内处于同一平面的原子不超过10个 | |
| C. | 1mol利尿酸能与7mol H2发生加成反应 | |
| D. | 利尿酸能与FeCl3溶液发生显色反应 |



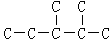 ,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH
,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH