题目内容
15.某化学实验小组设计了如图装置证明和比较SO2和氯水的漂白性,其中B、D中为品红溶液,C中为NaOH溶液.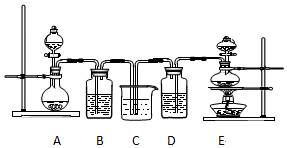
(1)该化学兴趣小组同学为制取Cl2和SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2.请写出制取Cl2的离子方程式:
MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O
(2)反应开始后,发现B、D两个装置中的品红溶液都褪色,停止通气后,取B、D溶液于试管中分别加热,两个试管中的现象分别为:B溶液恢复红色 D溶液仍无色.解释B中对应现象的原因二氧化硫与品红生成不稳定的无色物质,加热时无色物质分解又生红色的品红.
(3)装置C的作用是吸收多余的SO2和Cl2,防止污染环境
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:

通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①两同学在气体进入品红溶液之前,先将气体通过F装置,F中可盛装浓硫酸.其目的是使SO2和Cl2混合均匀并且通过观察气泡控制气体的流速.
②试分析甲同学实验过程中,品红溶液不褪色的原因是:SO2+Cl2+2H2O=4H++SO42-+2Cl-.(用离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?控制两种气体通入的量,使其物质的量不相等(或使其比例不等于1:1).
分析 要证明和比较SO2和氯水的漂白性,需制取二氧化硫和氯气,制二氧化硫用硫酸与亚硫酸钠,不用加热,制氯气用二氧化锰和浓盐酸并加热,则A装置制二氧化硫,E装置制氯气.
(1)实验室用二氧化锰与浓盐酸加热反应制备氯气;
(2)根据二氧化硫的漂白性是可逆的,而氯水的漂白性是不可逆的进行解答;
(3)二氧化硫和氯气都是有毒气体需要进行尾气处理,以免污染空气;
(4)①F中可盛装浓硫酸,其目的是使SO2和Cl2混合均匀并且通过观察气泡控制气体的流速;
②氯气和二氧化硫在水溶液中恰好发生氧化还原反应,转化成没有漂白性的盐酸和硫酸,所以品红溶液几乎不褪色;
③当通入的二氧化硫或者氯气一方有剩余时,又会使品红溶液褪色.
解答 解:(1)采用MnO2和浓盐酸(12mol/L)为原料制取Cl2.制取Cl2的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)SO2使品红褪色,生成不稳定的无色物质,可以看作是一个化合反应,该生成的无色物质不很稳定,受热又能分解放出SO2,而恢复原来的红色,氯气使品红褪色是氧化性漂白,不可还原,无法恢复,
故答案为:溶液恢复红色;溶液仍无色;二氧化硫与品红生成不稳定的无色物质,加热时无色物质分解又生红色的品红;
(3)氯气和二氧化硫都有毒,不能直接排放到空气中,所以用氢氧化钠吸收过量的二氧化硫和氯气,防止污染空气,
故答案为:吸收多余的SO2和Cl2,防止污染环境;
(4)①F中可盛装浓硫酸,其目的是使SO2和Cl2混合均匀并且通过观察气泡控制气体的流速;
故答案为:通过观察气泡控制气体的流速;
②氯气和二氧化硫在水溶液中恰好完全反应,反应的离子方程式为:SO2+Cl2+2H2O=4H++SO42-+2Cl-,生成的硫酸和盐酸不具有漂白性,所以品红溶液不褪色,
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
③当通入的二氧化硫或者氯气中一种气体过量,过量的氯气或者二氧化硫气体能够使品红褪色,
故答案为:控制两种气体通入的量,使其物质的量不相等(或使其比例不等于1:1).
点评 本题主要考查了二氧化硫的制备以及其相关性质的综合实验,解题过程中,应围绕课本基本知识,如“二氧化硫使品红溶液褪色”、“二氧化硫与氯气反应生成氯化氢和硫酸”等基础知识,同时,对于实验的设计,尤其是多因素影响的实验,应考虑“控制变量法”,题目难度中等.

 初中暑期衔接系列答案
初中暑期衔接系列答案(1)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如表:
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小 (填“增大”“不变”或“减小”).
③由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”).原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高.
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反 应中,在反应ClO2-+2SO32-═2SO42-+Cl-的平衡常数K表达式为$\frac{c(C{l}^{-})•{c}^{2}(S{O}_{4}^{2-})}{c(Cl{O}_{2}^{-})•{c}^{2}(S{O}_{3}^{2-})}$.
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果.已知下列反应:
SO2(g)+2OH- (aq)═SO32- (aq)+H2O(l)△H1
ClO- (aq)+SO32- (aq)═SO42- (aq)+Cl- (aq)△H2
CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO- (aq)+2OH- (aq)═CaSO4(s)+H2O(l)+Cl- (aq)的△H=△H1+△H2-△H3.
| A. | 30% | B. | 40% | C. | 60% | D. | 70% |
| A. | 室温下,1L pH=13的氢氧化钡溶液所含OH- 数为0.2NA | |
| B. | 标准状况下,0.1molAl3+含有的核外电子数为0.3 NA | |
| C. | 常温下,44gCO2中含有2NA个碳氧双键 | |
| D. | 将1 molN2 和3mol H2 通入密闭容器中,一定条件下充分反应,转移电子数为6NA |
 4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3 mol,则此反应的平均速率v为( )
4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3 mol,则此反应的平均速率v为( )
