题目内容
5.物质的量分别为1mol的下列微粒中,具有相同电子总数的一组微粒是( )| A. | K+和Na+ | B. | Al3+和Cl- | C. | OH-和NH4+ | D. | H2S和CH4 |
分析 根据微粒中的质子数和微粒所带的电荷数进行分析解答,阳离子的电子数是质子数-电荷数,阴离子的电子数是质子数+电荷数,据此解答
解答 解:A、钠离子的电子数是10,钾离子的电子数是18,故A错误;
B、Al3+电子数是10,Cl-电子数是18,故A错误;
C、OH-和NH4+的电子数是10,故C正确;
D、H2S的电子数是18,CH4的电子数是10,故D错误;
故选C.
点评 本题考查了物质的微观构成粒子中电子数的关系,题目难度不大,注意把握原子、离子中电子数与质子数的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列物质属于电解质的是( )
| A. | 稀硫酸 | B. | 三氧化硫 | C. | 铁 | D. | 硝酸铵 |
13.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 将NaHCO3固体加入新制氯水,有无色气泡生成(H+) | |
| B. | 使红色布条褪色(HClO) | |
| C. | 向NaBr溶液中滴加氯水,再滴加CCl4,发现下层为橙红色(HCl) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
20.下列叙述正确的是( )
| A. | 14N和14C属于不同核素,它们互为同位素 | |
| B. | 1H和2H是同种元素,它们核外电子数不相等 | |
| C. | 14C和14N的质量数相等,中子数也相等 | |
| D. | 6Li和7Li的质子数相等,二者互为同位素 |
10.下列物质与水反应能生成强酸的是( )
| A. | Cl2 | B. | Na2O | C. | CO2 | D. | NH3 |
14.下列离子组一定能大量共存的是( )
| A. | 常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| B. | 滴加石蕊试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| C. | 常温下由水电离出来的c(H+)=1×10-13mol•L-1的溶液中:K+、CO32-、Cl-、NO3- | |
| D. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、NO3- |
19.利用如图装置探究温度对氨气还原Fe203的影响(固定装置略).
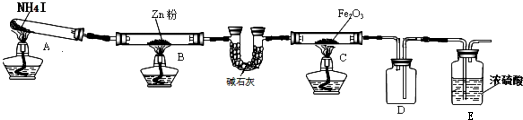
(1)实验时A中有大量紫红色的烟气,则NH4I的分解产物为NH3、H2、I2(HI)(至少填三种),碱石灰的作用是干燥及吸收酸性气体
(2)装置B中的反应化学方程式Zn+I2═ZnI2,D装置的作用是安全瓶,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置C加热,反应产物均为黑色粉末(纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
(3)乙组得到的黑色粉末是Fe;
(4)步骤1甲组中反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O;
(5)步骤3乙组中溶液变红的原因为Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色,
(6)若装置C中反应后的固体是Fe203和Fe0组成的混合物.为确定其组成.取样品7.84克,在加热条件下通入氨气,完全反应后,停止加热,反应管中铁粉冷却后,称得质量为5.6克,则混合物中Fe203和Fe0的物质的量之比为2:1.

(1)实验时A中有大量紫红色的烟气,则NH4I的分解产物为NH3、H2、I2(HI)(至少填三种),碱石灰的作用是干燥及吸收酸性气体
(2)装置B中的反应化学方程式Zn+I2═ZnI2,D装置的作用是安全瓶,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置C加热,反应产物均为黑色粉末(纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无明显变化 |
| 3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(4)步骤1甲组中反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O;
(5)步骤3乙组中溶液变红的原因为Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色,
(6)若装置C中反应后的固体是Fe203和Fe0组成的混合物.为确定其组成.取样品7.84克,在加热条件下通入氨气,完全反应后,停止加热,反应管中铁粉冷却后,称得质量为5.6克,则混合物中Fe203和Fe0的物质的量之比为2:1.
