题目内容
10.下列物质与水反应能生成强酸的是( )| A. | Cl2 | B. | Na2O | C. | CO2 | D. | NH3 |
分析 根据各物质与水反应的产物及常见的酸中盐酸、硝酸、硫酸都为强酸,而碳酸为弱酸来判断.
解答 解:A.因Cl2与水反应:Cl2+H2O?HClO+HCl,HCl是强酸,故A正确;
B.因Na2O与水反应:Na2O+2H2O═2NaOH,NaOH是强碱,故B错误;
C.因CO2与水反应:CO2+H2O?H2CO3,H2CO3是弱酸,故C错误;
D.因NH3与水反应:NH3+H2O?NH3•H2O?NH4++OH-,NH3•H2O为弱碱,故D错误;
故选A.
点评 本题主要考查了物质的性质,掌握物质的性质和相关化学方程式以及强酸的判断是解答的关键,题目比较简单.

练习册系列答案
相关题目
18.下列物质,不能由金属单质和稀盐酸反应得到的是( )
| A. | FeCl2 | B. | CuCl2 | C. | AlCl3 | D. | ZnCl2 |
5.物质的量分别为1mol的下列微粒中,具有相同电子总数的一组微粒是( )
| A. | K+和Na+ | B. | Al3+和Cl- | C. | OH-和NH4+ | D. | H2S和CH4 |
15.某硝酸盐M(NO3)2热分解化学方程式为:2M(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MO+4NO2↑+O2↑,加热18.8g
M(NO3)2使其完全分解,共收集5.6L气体(标准状况下),则M摩尔质量为( )
M(NO3)2使其完全分解,共收集5.6L气体(标准状况下),则M摩尔质量为( )
| A. | 64 g•mol-1 | B. | 24 g•mol-1 | C. | 56 g•mol-1 | D. | 188 g•mol-1 |
4.下列装置能达到实验目的是( )
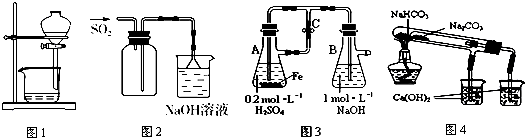

| A. | 图1用于放出碘的苯溶液 | |
| B. | 图2用于实验室收集SO2 | |
| C. | 图3用于实验室制备Fe(OH)2 | |
| D. | 图4用于比较NaHCO3和Na2CO3热稳定性 |

