题目内容
14.氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可以生成NH3.请回答下列问题:(1)氮化钠的电子式为
 ,该化合物是由离子键形成的.
,该化合物是由离子键形成的.(2)Na3N与盐酸反应生成2种盐,其电子式为
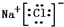 、
、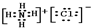 .
.(3)在上述盐中,既有离子键,又含有极性共价键的是NH4Cl.
(4)比较氮化钠中两种微粒的半径r(Na+)小于r(N3-).
分析 (1)氮化钠是离子化合物,三个钠原子失去三个电子,给N原子,使N原子最外层达到稳定结构,电子式需要标注离子所带电荷数;
(2)先写出氮化钠和水反应的方程式,再写出氨气和氢氧化钠与盐酸反应的方程式,根据方程式判断生成盐的种类,并写出电子式;
(3)NH4Cl中既有离子键,又含有极性共价键、NaCl中只含离子键;
(4)这两种离子的核外电子排布相同,核外电子排布相同,离子半径随原子序数的增大而减小.
解答 解:(1)氮化钠是离子化合物,三个钠原子失去三个电子,给N原子,使N原子最外层达到稳定结构,其电子式为: ,是离子键形成的离子化合物,故答案为:
,是离子键形成的离子化合物,故答案为: ;离子键;
;离子键;
(2)Na3N+3H2O=NH3+3NaOH ①
NH3+HCl=NH4Cl ②
NaOH+HCl=NaCl+H2O ③
所以生成的盐有2种,分别是 NH4Cl、NaCl.
NH4Cl和NaCl都是离子化合物,所以其电子式分别为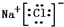 、
、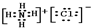 .
.
故答案为:2;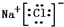 、
、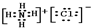 ;
;
(3)NH4Cl中既有离子键,又含有极性共价键、NaCl中只含离子键,故答案为:NH4Cl;
(4)这两种离子的核外电子排布相同,核外电子排布相同,离子半径随原子序数的增大而减小,故r(Na+)<r(N3-),
故答案为:小于r(N3-).
点评 本题考查电子式、化学反应方程式、化学键、离子半径的大小比较等知识,主要是物质性质的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
7.下列说法正确的是( )
| A. | 常温下.NH4Cl溶液加水稀释,$\frac{c(N{H}_{3•}{H}_{2}O)•c({H}^{+})}{c(N{{H}_{4}}^{+})}$增大 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的pH减小 | |
| C. | 室温下稀释O.lmol/LCH3COOH溶液,溶液的导电能力减弱,因此溶液中所有离子浓度均减小 | |
| D. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进Fe3+水解 |
2.下列金属冶炼的反应原理,错误的是( )
| A. | 2AlCl3(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Al+3Cl2↑ | B. | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Na+Cl2↑ | ||
| C. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |
19.在容量瓶上无需标有( )
| A. | 刻度线 | B. | 容量标准 | C. | 浓度 | D. | 温度 |
5.游泳池是公共场合,必须保持用水的清洁卫生,游泳池中的水常用漂白粉消毒,漂白粉的有效成分是( )
| A. | CaCl2 | B. | Ca(ClO)2 | C. | Ca(OH)2 | D. | HClO |
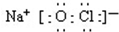 ;若将84消毒液长期露置于空气中,溶液中的主要成分最终将变为NaCl.(填化学式)
;若将84消毒液长期露置于空气中,溶液中的主要成分最终将变为NaCl.(填化学式)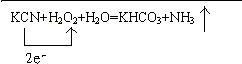 .
.