题目内容
16.从海水中提取下列物质,可以不涉及化学变化的是( )| A. | Mg | B. | Br2 | C. | NaCl | D. | K |
分析 根据从海水制备物质的原理可知,氯化钠含量比较高,可利用蒸发原理得到,金属单质与非金属单质需要利用化学反应来制取,据此即可解答.
解答 解:A.海水中得到镁,需要首先从海水中获得氯化镁,然后再去电解熔融状态的氯化镁而得到镁,涉及化学变化,故A不选;
B.从海水中获得单质溴,通过氯气将溴离子氧化为溴单质,涉及化学变化,故B不选;
C.海水中氯化钠含量比较高,把海水用太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故C选;
D.海水中得到钾,需要首先从海水中获得氯化钾,然后再去电解熔融状态的氯化钾而得到甲,涉及化学变化,故D不选;
故选:C.
点评 本题考查了从海水中获取化合物和单质的方法,熟悉物质的存在及物质的性质是解答本题的关键,注意物理变化与化学变化判断依据:是否有新物质生成,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列离子方程式正确的是( )
| A. | FeCl3溶液中加入过量的氨水:Fe3++3OH-→Fe(OH)3↓ | |
| B. | AlCl3溶液中加入过量的氨水:Al3++4OH-→AlO2-+2H2O | |
| C. | 金属铁与过量的稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| D. | 氧化铝与氢氧化钠溶液反应:Al2O3+2OH-→2AlO2-+H2O |
7.下列说法正确的是( )
| A. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 具有相同电子层结构的四种离子A+、B2+、C-、D2-,它们的半径由大到小的顺序是D2->C->A+>B2+ | |
| C. | 分子内部一定含有共价键 | |
| D. | 族序数等于周期序数的元素一定是金属元素 |
11.下列分析中正确的是( )
| A. | 烷烃在任何情况下均不与强酸、强碱、氧化剂反应 | |
| B. | 正丁烷分子中四个碳原子可能在同一直线上 | |
| C. | 常温常压下 是气态 是气态 | |
| D. | 含有碳元素的化合物不一定是烃 |
8. 1799年,科学家伏打(即伏特)以含食盐水的湿抹布,夹在铜和锌的圆木板中间,堆积成圆柱状,制造出最早的电池-伏特电池.下列说法不正确的是( )
1799年,科学家伏打(即伏特)以含食盐水的湿抹布,夹在铜和锌的圆木板中间,堆积成圆柱状,制造出最早的电池-伏特电池.下列说法不正确的是( )
 1799年,科学家伏打(即伏特)以含食盐水的湿抹布,夹在铜和锌的圆木板中间,堆积成圆柱状,制造出最早的电池-伏特电池.下列说法不正确的是( )
1799年,科学家伏打(即伏特)以含食盐水的湿抹布,夹在铜和锌的圆木板中间,堆积成圆柱状,制造出最早的电池-伏特电池.下列说法不正确的是( )| A. | 该装置可以把化学能转化为电能 | |
| B. | 锌电极为负极 | |
| C. | 铜电极电极反应O2+2H2O+4e-=4OH- | |
| D. | 可用浸有酒精溶液的棉布代替浸有食盐水的棉布 |
4.某实验小组用50mL 1.0mol/L的盐酸与50mL 1.1mol/L的NaOH溶液在如图1所示装置进行中和热的测定,请回答下列问题:
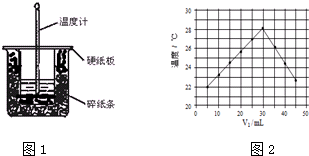
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器
(2)做1次完整的中和热测定实验,温度计需使用3次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?不同意,因为不同温度计误差不同
(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如图原始数据.
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混和液的比热容 C=4.18J(g•℃)则该反应的中和热为
△H=-56.8kJ/mol
(4)将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL)
下列叙述正确的是B
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.0mol/L
D.该实验表明有水生成的反应都是放热反应.

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器
(2)做1次完整的中和热测定实验,温度计需使用3次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?不同意,因为不同温度计误差不同
(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如图原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
| 3 | 25.1 | 25.1 | 25.1 | 33.6 | 8.5 |
△H=-56.8kJ/mol
(4)将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL)
下列叙述正确的是B
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.0mol/L
D.该实验表明有水生成的反应都是放热反应.
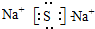 .
.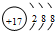 ,该元素的氢化物遇到氨气会产生大量的白烟,产生白烟的化学方程式为NH3+HCl=NH4Cl.
,该元素的氢化物遇到氨气会产生大量的白烟,产生白烟的化学方程式为NH3+HCl=NH4Cl.