题目内容
5.根据元素周期表及周期律的知识回答下列问题:(1)短周期中原子半径最大的元素(不考虑稀有气体)位于周期表的第三周期第IA族,该元素与硫元素形成的化合物的电子式为
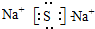 .
.(2)短周期中与氟元素同主族的元素是Cl(氯),其离子的结构示意图为
 ,该元素的氢化物遇到氨气会产生大量的白烟,产生白烟的化学方程式为NH3+HCl=NH4Cl.
,该元素的氢化物遇到氨气会产生大量的白烟,产生白烟的化学方程式为NH3+HCl=NH4Cl.(3)下列关于元素性质的比较中正确的是a.
a.原子半径:Al>Si>C
b.非金属性:P>S>Cl
c.热稳定性:H2O>HF>H2S
d.碱性:KOH<Ca(OH)2<Mg(OH)2.
分析 (1)电子层越多,原子半径越大,同周期从左向右原子半径减小;钠与S形成离子化合物硫化钠;
(2)短周期中与氟元素同主族的元素为Cl,离子中质子数为17,电子数为18,HCl与氨气反应生成氯化铵;
(3)a.电子层越多,原子半径越大,同周期从左向右原子半径减小;
b.同周期从左向右非金属性增强;
c.非金属性越强,对应氢化物越稳定;
d.金属性越强,对应碱的碱性越强.
解答 解:(1)电子层越多,原子半径越大,同周期从左向右原子半径减小,则短周期中原子半径最大的元素为Na,位于周期表的第三周期第IA族,该元素与硫元素形成的化合物的电子式为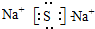 ,
,
故答案为:三;IA;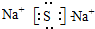 ;
;
(2)短周期中与氟元素同主族的元素为Cl,离子中质子数为17,电子数为18,离子结构示意图为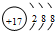 ,HCl与氨气反应生成氯化铵,该反应为NH3+HCl=NH4Cl,
,HCl与氨气反应生成氯化铵,该反应为NH3+HCl=NH4Cl,
故答案为:Cl(氯);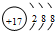 ;NH3+HCl=NH4Cl;
;NH3+HCl=NH4Cl;
(3)a.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:Al>Si>C,故a正确;
b.同周期从左向右非金属性增强,则非金属性:P<S<Cl,故b错误;
c.非金属性越强,对应氢化物越稳定,则热稳定性:HF>H2O>H2S,故c错误;
d.金属性越强,对应碱的碱性越强,则碱性:KOH>Ca(OH)2>Mg(OH)2,故d错误;
故答案为:a.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
16.从海水中提取下列物质,可以不涉及化学变化的是( )
| A. | Mg | B. | Br2 | C. | NaCl | D. | K |
16.下列关于化学键的叙述正确的是( )
| A. | 离子化合物一定不含共价键 | B. | 化学键的形成与原子结构无关 | ||
| C. | 共价键只存在于共价化合物中 | D. | 离子键只存在于离子化合物中 |
13.下列装置能达到实验目的是( )
| A. | 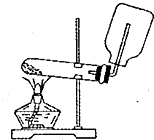 实验室制取并收集氨气 | B. | 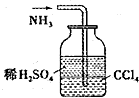 吸收氨气 | ||
| C. | 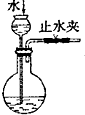 代替启普发生器 | D. | 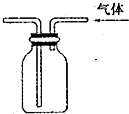 排空气法收集二氧化碳 |
20.联合国卫生组织经过考核和研究,认为我国使用的铁锅是有益于人类健康的理想炊具,并向全世界推广.其主要原因是( )
| A. | 价格便宜,不易生锈 | |
| B. | 铁锅含有碳元素 | |
| C. | 烹调的食物中留有人体需要的铁元素 | |
| D. | 传热慢,保温性能好 |
10.能得到Fe2O3 的实验是( )
| A. | 铁在纯氧中燃烧 | B. | 红热的铁和水蒸气反应 | ||
| C. | 蒸干并灼烧Fe2(SO4)3溶液 | D. | 灼烧氢氧化铁固体 |
17.请选择合适的选项编号填入表格:
除杂可用试剂:
a.碱石灰 b.水 c.浓硫酸 d.饱和食盐水
收集气体方法:

除杂可用试剂:
a.碱石灰 b.水 c.浓硫酸 d.饱和食盐水
收集气体方法:

| 气体 | 所含杂质气体 | 除杂所用试剂 | 收集气体方法(已去除杂质) |
| 氨气 | 水蒸气 | a | B |
| 一氧化氮 | 二氧化氮 | b | A |
14.下列离子方程式正确的是( )
| A. | 金属铝溶于氢氧化钠溶液 Al+2OH-→AlO2-+H2↑ | |
| B. | 铁跟稀硫酸反应:Fe+2H+→Fe2++H2↑ | |
| C. | 碳酸钙跟盐酸反应:CO32-+2H+→CO2↑+H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++3OH-→Al(OH)3↓ |
15.只需要用下列试剂中的一种,即可将AlCl3、NaAlO2、AgNO3、NaHCO3四种无色溶液区别开.这种试剂是( )
| A. | 氢氧化钠溶液 | B. | 浓氨水 | C. | 盐酸 | D. | 硝酸 |