题目内容
11.某化学兴趣小组为了研究外界条件对化学反应速率的影响,进行了如下实验:【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大.
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 (KMnO4)=1.5×10-2mol•L-1•min-1或0.015 mol•L-1•min-1.
(3)该小组同学根据经验绘制了 (Mn2+) 随时间变化趋势的示意图,如图甲所示.但有同学查阅已有的实验资料发现,该实验过程中 (Mn2+) 随时间变化的趋势应如图乙所示. 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究.
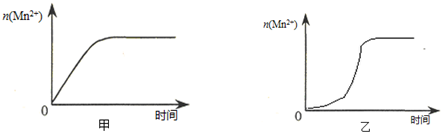
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | ||
③若该小组同学提出的假设成立,应观察到的现象是实验4与实验1比较,溶液褪色所需时间短 或:溶液褪色所用时间(t)小于4min.
分析 (1)从表中数据可知改变的条件是KMnO4浓度,根据褪色时间判断溶液浓度对反应速率的影响反应物浓度增大;
(2)先根据醋酸和高锰酸钾的物质的量判断过量问题,计算高锰酸钾浓度变化量,再根据v=$\frac{△C}{△t}$计算;
(3)①由图乙可知,反应开始后锰离子浓度增大,反应速率增加的比较快,所以探究的是硫酸锰在反应中的作用;
②作对比实验时,除了加入MnSO4不同外,其它量完全相同;
③若反应加快,说明Mn2+是催化剂,反应过程中溶液褪色时间减少.
解答 解:(1)从表中数据,可知改变的条件是KMnO4浓度,其他条件相同时,增大KMnO4浓度,褪色时间变短,则反应速率增大,
故答案为:其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大;
(2)草酸的物质的量为:0.6mol•L-1×0.003L=0.0018mol,高锰酸钾的物质的量为:0.2mol•L-1×0.003L=0.0006mol,草酸和高锰酸钾的物质的量之比为:0.0018mol:0.0006mol=3:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:$\frac{0.2mol•{L}^{-1}×0.003L}{(3+2+3+2)×1{0}^{-3}L}$=0.06mol/L,
这段时间内平均反应速率v(KMnO4)=$\frac{0.06mol•{L}^{-1}}{4min}$=1.5×10-2 mol/(L•min),
故答案为:1.5×10-2mol•L-1•min-1或0.015 mol•L-1•min-1;
(3)①由图乙可知,反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂,
故答案为:生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同,所以加入的少量固体为MnSO4,
故答案为:MnSO4;
③若该小组同学提出的假设成立,则反应速率加快,溶液褪色的时间小于4min,从而说明Mn2+是催化剂,
故答案为:实验4与实验1比较,溶液褪色所需时间短或:溶液褪色所用时间(t)小于4min.
点评 本题主要结合实验考查了外界条件对化学反应速率的影响,题目难度不大,注意对比分析图表中的数据找出相同点和不同点,利用控制变量法分析解答,难度中等.

 发散思维新课堂系列答案
发散思维新课堂系列答案
| A. | 用图①装置比较KMnO4、Cl2、I2的氧化性强弱 | |
| B. | 用图②装置验证过氧化钠与水反应既生成氧气又放热 | |
| C. | 用图③装置可制得金属锰 | |
| D. | 用图④装置制取并收集干燥纯净的NH3 |
| A. | 0.01molFeCl3与沸水反应,形成Fe(OH)3胶粒数目小于0.01NA | |
| B. | 常温下,27g铝片加入足量浓硝酸中,转移的电子数目为3NA | |
| C. | 1mol甲苯含有6NA个C-H键 | |
| D. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
 某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.(1)该反应的离子方程式:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O.
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ |
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是生成的Mn2+催化反应的进行.若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是B.
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)可以利用酸性高锰酸钾测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数.该小组称量2.68g草酸钠样品溶于稀硫酸中,然后用0.2000mol•L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应 ).
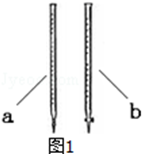
①滴定前是否要滴加指示剂?否(填“是”或“否”),当溶液由无色变为紫红色,且在半分钟内不褪色,说明滴定达到终点.
②滴定时用b(填a或b )滴定管盛装KMnO4标准溶液.
③达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为37.5%.

实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,AlCl3,FeCl3遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
(1)写出装置A中发生反应的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,装置D的硬质玻璃管中发生的主要反应的化学方程式是SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO.
(2)装置C中的试剂是浓硫酸;D、E间导管短且粗的原因是防止生成物中的AlCl3,FeCl3等杂质凝结成固体堵塞导管.
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)
【提出假设】假设1:只有SO32-:假设2:既无SO32-也无ClO-;假设3:只有ClO-
【设计方案,进行试验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH、0.01mol/L KMnO4溶液、溴水、淀粉-KI、品红等溶液.
取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验:请完成下表:
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 则假设2成立 | ||
| ③ | 向c试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 则假设3成立 |

请回答以下问题:
(1)为验证气体A,按图2所示进行实验:若能观察到KMnO4溶液(紫红色)褪色的现象,即可证明火柴头上含有S元素.
(2)要证明火柴头中含有Cl元素的后续实验步骤是取滤液C,加入HNO3和AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素.
(3)有学生提出检验火柴头上KClO3另一套实验方案:(如图3)

有关的离子反应方程式为ClO3-+3NO2-+Ag+=AgCl↓+3NO3-,有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO3的存在,其理由是二氧化锰和浓盐酸加热也发生反应生成氯气.
(4)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验.
| 实验次数 | H2O2溶液质量分数% | H2O2溶液用量/毫升 | 物质D用量/克 | 反应温度/℃ | 收集气体体积/毫升 | 所需时间/秒 |
| ① | 30 | 5 | 0 | 85 | 2 | 3.8 |
| ② | 15 | 2 | 0.1 | 20 | 2 | 2.8 |
| ③ | 15 | 2 | 0.2 | 20 | 2 | 2.2 |
| ④ | 5 | 2 | 0.1 | 20 | 2 | 7.4 |
| ⑤ | 30 | 5 | 0 | 55 | 2 | 10.5 |
(5)写出步骤①中发生反应的两个化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.