题目内容
1.以下是关于“外界因素对化学平衡移动影响的实验研究”的课题,回答问题:(1)影响化学平衡因素的界定:化学平衡发生移动的本质原因是a.所以影响化学平衡因素可以从分析影响该原因的因素入手.
a.V(正)≠V(逆) b.V(正)和V(逆)都增大 c.V(正)和V(逆)都减小
(2)研究的思路与方法
①研究对象的选择:有以下可逆反应:
A.2NO2(g)?N2O4(g)+Q(Q>0)
B.FeCl3+3KSCN?Fe(SCN)3+3KCl+Q
其中,A适合于研究a、b、c对平衡的影响,B适合于研究a、b对平衡的影响.
a.浓度 b.温度 c.压强 d.催化剂
②研究方法:采用控制其它因素不变,改变其中一个因素的方法,并进行对比实验.
(3)单一因素对化学平衡移动影响的实验研究
a.浓度:将FeCl3与KSCN反应后所得的混合液分为3等份,分别加入浓FeCl3溶液、浓KSCN溶液、NaCl固体,观察现象.
现象:加入浓FeCl3溶液后的混合溶液红色变深;加入浓KSCN溶液后混合溶液红色变深;加入NaCl固体后,混合溶液红色不变.
b.温度:将密封并相互连通的盛有NO2的2个玻璃球,1个放入热水中,另一个放入冷水中.现象:放入热水中的球内红棕色变深;放入冷水中的球内红棕色变浅.
(4)实验研究(3)能得出的影响化学平衡移动的原因是在其它条件不变时,增大反应物浓度,平衡向正反应方向移动;升高温度,平衡向吸热反应方向移动,降低温度,平衡向放热方向移动.
分析 (1)当正逆反应速率相等时,可逆反应达到平衡状态,如果正逆反应速率不相等,则化学平衡一定发生移动;
(2)根据反应物、生成物的状态及影响化学平衡的因素进行判断;
(3)分析可逆反应特点,然后根据浓度、温度对化学平衡的影响进行解答;
(4)根据(3)中温度、压强对化学平衡的影响进行解答
解答 解:(1)化学平衡状态的特征为V(正)=V(逆),所以化学平衡发生移动的本质原因是正逆反应速率不相等,即V(正)≠V(逆),
故答案为:a;
(2)反应A.2NO2(g)?N2O4 (g)△H<0中,反应前后气体体积不相等,反应为放热反应,则温度、压强、浓度都会影响化学平衡,但是催化剂不影响平衡,所以反应A适合于研究温度、压强、浓度对平衡应的影响,即abc正确;
反应FeCl3+3KSCN?Fe(SCN)3+3KCl在溶液中进行,压强和催化剂不影响平衡,而温度和浓度会影响平衡,所以B适合研究温度、压强对平衡的影响,即ab正确,
故答案为:abc;ab;
(3)a.浓度:将FeCl3与KSCN反应后所得的混合液分为3等份,Fe3++3SCN-?Fe(SCN)3,Fe(SCN)3为血红色,分别加入浓FeCl3溶液、浓KSCN溶液和NaCl固体,观察现象,现象:加入浓FeCl3溶液后,铁离子浓度增大,平衡向着正向移动,Fe(SCN)3浓度增大,则混合溶液红色变深;加入浓KSCN溶液后,增大了SCN-浓度,平衡向正方向移动,混合溶液红色也变深;加入NaCl固体后,对平衡无影响,混合溶液红色不变,
故答案为:变深;变深;不变;
b.温度:将密封并相互连通的盛有NO2的两个玻璃球,一个放人热水中,另一个放入冷水中;
现象:由于反应2NO2(g)?N2O4 (g)△H<0为放热反应,升高温度后平衡向着逆向移动,二氧化氮浓度增大,球内红棕色变深;
放入冷水中,平衡向着正向移动,二氧化氮浓度减小,则球内红棕色变浅,
故答案为:变深;变浅;
(4)根据(3)浓度、温度对化学平衡的影响可知:在其它条件不变时,增大反应物浓度,平衡向正方向移动;升高温度,平衡向吸热方向移动,降低温度,平衡向放热方向移动,
故答案为:在其它条件不变时,增大反应物浓度,平衡向正反应方向移动;升高温度,平衡向吸热反应方向移动,降低温度,平衡向放热方向移动.
点评 本题探究温度、压强、浓度对化学平衡的影响,题目难度不大,注意掌握影响化学平衡的因素,明确化学平衡移动的根本原因,试题培养了学生灵活应用所学知识的能力.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | PCl5 | B. | H2O | C. | CO2 | D. | BF3 |
| A. | 39K+和40Ca2+微粒中的电子数和中子数都相等 | |
| B. | D2和He在同温同压时,若体积相等,则质量相等 | |
| C. | 同一元素的各种同位素的物理性质、化学性质均不相同 | |
| D. | 两个质量数和电子数都相等的微粒不一定是同种元素 |
| A. | 加入氯化铵晶体 | B. | 加入氢氧化钠溶液 | ||
| C. | 加入硫酸溶液 | D. | 加入氯化钾晶体 |
 某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.(1)该反应的离子方程式:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O.
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ |
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是生成的Mn2+催化反应的进行.若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是B.
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)可以利用酸性高锰酸钾测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数.该小组称量2.68g草酸钠样品溶于稀硫酸中,然后用0.2000mol•L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应 ).
①滴定前是否要滴加指示剂?否(填“是”或“否”),当溶液由无色变为紫红色,且在半分钟内不褪色,说明滴定达到终点.
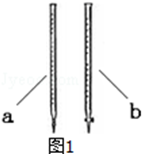
②滴定时用b(填a或b )滴定管盛装KMnO4标准溶液.
③达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为37.5%.
 实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
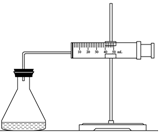
(1)欲用如图装置来比较该反应的反应速率快慢,如何检查装置气密性:将注射器活塞向外拉出一段,过一会后活塞回到原位,说明气密性良好.
(2)当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测相同时间内收集的气体体积或收集相同体积的气体需要的时间计算反应速率.
(3)为实现实验目的,则V1=20.0,V2=20.0;V3=10.0,V4=5.0.
(4)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是C(填“实验编号”)
(5)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3++H2O2═2Fe2++O2↑+2H+,则第二步反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O.
| A. | 氢氧根离子的电子式是: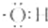 | B. | 甲烷分子的比例模型是: | ||
| C. | 硝基的表示方法-NO2 | D. | 饱和烃的通式是CnH2n+2(n≥1) |
| A. | 苯的硝化反应中,向浓硫酸中加浓硝酸制得混合酸 | |
| B. | 向稀氨水中逐渐加入硝酸银溶液来配制银氨溶液 | |
| C. | 向相对过量的氢氧化钠溶液中滴入少量硫酸铜溶液以配制新制氢氧化铜 | |
| D. | 溴乙烷在氢氧化钠溶液的存在下进行水解后,加入硝酸银溶液,可检验溴离子的存在 |
 甲烷可用氧化铁作催化剂实现选择性地催化脱硝.
甲烷可用氧化铁作催化剂实现选择性地催化脱硝.