题目内容
12.理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题:(1)该电池选择的电解质溶液是AgNO3(填化学式);
(2)正极电极反应的离子方程式是Ag++e-=Ag;
(3)若导线上转移电子1mol,则生成银的质量为108g.
分析 (1)根据方程式,失电子的物质作负极;电解质溶液中含有得电子的Ag+;
(2)得电子的物质在正极上反应,结合方程式判断得电子的离子,从而写出电极反应式;
(3)根据正极反应式计算Ag的物质的量,带入m=nM计算质量.
解答 解:(1)原电池中失电子的物质作负极,根据反应方程式知,Cu作负极,电解质溶液中含有得电子的Ag+,可用硝酸银溶液作电解质溶液,
故答案为:AgNO3;
(2)在正极上银离子得电子生成银单质,电极反应式为Ag++e-=Ag,
故答案为:Ag++e-=Ag;
(3)由Ag++e-=Ag可知,导线上转移电子1mol,则生成1molAg,质量为1mol×108g/mol=108g,
故答案为:108.
点评 本题考查原电池的设计,题目难度不大,注意两极材料的判断以及电极反应式的书写方法.

练习册系列答案
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
3.某高聚物的结构如图所示,下列说法正确的是( )


| A. | 该高聚物为加聚产物 | B. | 该高分子为体型高分子 | ||
| C. | 该高分子的单体有6种 | D. | 该高分子中含有酯基 |
7.下列分子中,所有原子都满足最外层8电子结构的是( )
| A. | PCl5 | B. | H2O | C. | CO2 | D. | BF3 |
4.用R代表短周期元素,R最外层的2p能级上的未成对电子有3个,下列关于R的描述正确的是( )
| A. | R的氧化物一定能溶于水 | |
| B. | R的最高价氧化物对应水化物是H2RO3 | |
| C. | R的氢化物的水溶液呈碱性 | |
| D. | R的氧化物都能与NaOH反应 |
1.化学与生活息息相关,下列说法错误的是( )
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 淀粉、纤维素、聚乙烯、油脂、蛋白质都是高分子化合物 | |
| D. | 人们使用的装饰材料、内墙涂料释放出的甲醛是居室空气污染的主要来源之一 |
6. 某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
(1)该反应的离子方程式:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O.
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(3)在完成探究催化剂对该反应速率影响的实验时发现,未加催化剂的情况下,刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是生成的Mn2+催化反应的进行.若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是B.
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)可以利用酸性高锰酸钾测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数.该小组称量2.68g草酸钠样品溶于稀硫酸中,然后用0.2000mol•L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应 ).
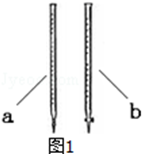
①滴定前是否要滴加指示剂?否(填“是”或“否”),当溶液由无色变为紫红色,且在半分钟内不褪色,说明滴定达到终点.
②滴定时用b(填a或b )滴定管盛装KMnO4标准溶液.
③达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为37.5%.
 某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.(1)该反应的离子方程式:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O.
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ |
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是生成的Mn2+催化反应的进行.若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是B.
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)可以利用酸性高锰酸钾测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数.该小组称量2.68g草酸钠样品溶于稀硫酸中,然后用0.2000mol•L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应 ).
①滴定前是否要滴加指示剂?否(填“是”或“否”),当溶液由无色变为紫红色,且在半分钟内不褪色,说明滴定达到终点.
②滴定时用b(填a或b )滴定管盛装KMnO4标准溶液.
③达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为37.5%.
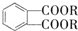 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
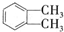 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.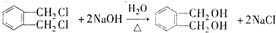 .
. .
. .
.