题目内容
14.标准状况下,将20LCO2和CO的混合气体缓慢通过足量的Na2O2粉末,在相同状况下,气体体积减少到16L,则原混合气体中CO的体积为( )| A. | 4L | B. | 8L | C. | 10L | D. | 12L |
分析 混合气体中只有CO2和Na2O2反应,反应方程式为2CO2+2Na2O2=2Na2CO3+O2,利用差量法计算二氧化碳体积,然后计算出原混合气体中CO的体积.
解答 解:混合气体中只有CO2和Na2O2反应,反应方程式为2CO2+2Na2O2=2Na2CO3+O2,设二氧化碳体积为x,
2CO2+2Na2O2=2Na2CO3+O2 体积减少
44.8L 22.4L
x (20-16)L
则:44.8L:22.4L=x:(20-16)L
解得:x=8L
则原混合气体中CO的体积为:V(CO)=(20-8)L=12L,
故选D.
点评 本题考查混合物的有关计算,题目难度中等,明确反应中气体体积变化的根本原因是解本题关键,侧重考查学生分析计算能力,注意差量法的灵活运用.

练习册系列答案
相关题目
5.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 500℃左右比室温更有利于合成氨的反应(△H<0) | |
| C. | 红棕色的NO2加压后颜色先变深再变浅(2 NO2?N2O4(无色)) | |
| D. | 光照新制的氯水时,溶液的pH逐渐减小 |
9.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则( )
| A. | 反应过程中得到8.96 L的气体 | B. | 最终得到的溶液中溶质为NaCl | ||
| C. | 最终Al元素全部以沉淀形式存在 | D. | 最终得到的溶液中n(NaCl)=0.3 mol |
6.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1molNa2CO3含有的Na+离子数为2 NA | |
| C. | 通常状况下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 1mol/L的MgCl2溶液中,含有Cl- 个数为2 NA |
3.常温下向20.00mL 0.10mol/L Na2CO3溶液中逐滴加入0.10mol/L盐酸40.00mL,所得溶液的pH与加入盐酸体积的关系如表所示:
回答下列问题:
(1)20.00mL0.10mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-)(用等式表示).
(2)当V(HCl)=20.00mL时,溶液呈碱性的原因是溶液中存在平衡:HCO3-+H2O?H2CO3+OH-,HCO3-?H++CO32-,HCO3-的水解程度大于电离程度,溶液呈碱性(用离子方程式和必要的文字说明)此时溶液中c(H2CO3)>(填“>”、“<”或“=”)c(CO32-).
(3)V(HCl)=40.00mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的电离常数K1=2.5×10-6.此时保持其他条件不变,继续加入0.1mol/L盐酸10.00mL,K1将不变(填“变大”、“变小”或“不变”).
(4)若向20mL0.10mol/LNa2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(BaCO3)=9.5×10-9.
| 溶液的pH | 加入盐酸的总体积 |
| 12 | V(HCl)=0 |
| 8 | V(HCl)=20.00mL |
| 5 | V(HCl)=40.00mL |
(1)20.00mL0.10mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-)(用等式表示).
(2)当V(HCl)=20.00mL时,溶液呈碱性的原因是溶液中存在平衡:HCO3-+H2O?H2CO3+OH-,HCO3-?H++CO32-,HCO3-的水解程度大于电离程度,溶液呈碱性(用离子方程式和必要的文字说明)此时溶液中c(H2CO3)>(填“>”、“<”或“=”)c(CO32-).
(3)V(HCl)=40.00mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的电离常数K1=2.5×10-6.此时保持其他条件不变,继续加入0.1mol/L盐酸10.00mL,K1将不变(填“变大”、“变小”或“不变”).
(4)若向20mL0.10mol/LNa2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(BaCO3)=9.5×10-9.
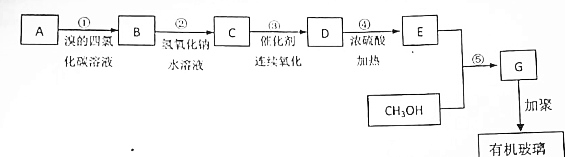
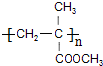 .
. ,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.