题目内容
下列叙述不正确的是( )
| A、Na、Mg、Al元素最高化合价依次升高 |
| B、P、S、Cl元素最高价氧化物对应的水化物酸性依次增强 |
| C、N、O、F元素非金属性依次减弱 |
| D、Li、Na、K原子的电子层数依次增多 |
考点:非金属在元素周期表中的位置及其性质递变的规律,金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:A、根据最外层电子数多少判断;
B、非金属性越强,最高价氧化物对应的水化物酸性越强;
C、同周期从左到右非金属性依次增强;
D、同主族从上到下电子层数依次增多.
B、非金属性越强,最高价氧化物对应的水化物酸性越强;
C、同周期从左到右非金属性依次增强;
D、同主族从上到下电子层数依次增多.
解答:
解:A、主族元素的最高正化合价等于其最外层电子数,则Na、Mg、Al元素最高化合价依次升高,故A正确;
B、非金属性越强,最高价氧化物对应的水化物酸性越强,非金属性:P<S<Cl,则最高价氧化物对应的水化物酸性:HClO4>H2SO4>H3PO4,故B正确;
C、同周期从左到右非金属性依次增强,所以N、O、F元素非金属性依次增强,故C错误;
D、同主族从上到下电子层数依次增多,则Li、Na、K原子的电子层数依次增多,故D正确;
故选C.
B、非金属性越强,最高价氧化物对应的水化物酸性越强,非金属性:P<S<Cl,则最高价氧化物对应的水化物酸性:HClO4>H2SO4>H3PO4,故B正确;
C、同周期从左到右非金属性依次增强,所以N、O、F元素非金属性依次增强,故C错误;
D、同主族从上到下电子层数依次增多,则Li、Na、K原子的电子层数依次增多,故D正确;
故选C.
点评:本题考查了元素周期律和元素周期表的应用,注意把握同周期、同主族元素性质的递变规律,题目难度不大.

练习册系列答案
相关题目
短周期主族元素A、B、C、D、E的原子序数依次递增,A的单质在常温下呈气态,D元素的单质既能与盐酸反应也能与NaOH溶液反应,B、C、E原子的最外层电子数之和为13,E原子的最外层电子数是B原子内层电子数的3倍或是C原子最外层电子数的3倍.下列说法正确的是( )
| A、原子半径的大小顺序:r(B)>r(C)>r(A) |
| B、元素E的氧化物的水化物一定是强酸 |
| C、D单质在一定条件下可以与氧化铁发生置换反应 |
| D、工业上常用电解元素C、D的氯化物来制取它们的单质 |
下列关于有机物的表述正确的是( )
| A、油脂、淀粉、蛋白质均为可水解的高分子化合物 | ||||
| B、乙烯、苯、乙酸分子中的所有原子都在同一平面上 | ||||
| C、石油催化裂化的主要目的是为了获得汽油等轻质油 | ||||
D、实验室中制取乙酸乙酯的化学方程式为CH3COOH+H18OC2H5
|
下列变化中(不考虑电解),必须加入氧化剂才能实现的是( )
| A、Cl-→Cl2 |
| B、Fe3+→Fe2+ |
| C、Al3+→AlO2- |
| D、H2O2→O2 |
20mL 1mol/L NaCl溶液和40mL 0.5mol/L MgCl2溶液混合之后(体积的变化忽略不计),混合液中Cl-的物质的量浓度为( )
| A、0.5 mol/L |
| B、0.6 mol/L |
| C、1 mol/L |
| D、2 mol/L |
某有机物的结构简式如图,下列叙述错误的是( )
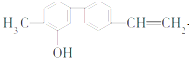

| A、一个分子中含有14个H原子 |
| B、苯环上一氯取代物有2种 |
| C、含有一种含氧官能团 |
| D、分子式是C15H14O |
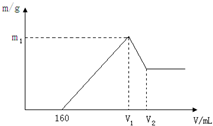 将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:
将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题: