题目内容
6.下列描述中正确的是( )| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中所有原子均满足8电子稳定结构 | |
| D. | SiF4和SO32-的中心原子均为印sp3杂化 |
分析 A.CS2与CO2分子构型相同,根据二氧化碳的分子结构分析;
B.先求出中心原子的价层电子对数,再判断分子构型;
C.化合物分子中某原子最外层电子数=元素原子最外层电子数+该元素原子化合价绝对值,若该值等于8,则该原子满足8电子结构;
D.先求出中心原子的价层电子对数,再判断杂化类型.
解答 解:A.CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O,则CS2的结构为S=C=S,属于直线形分子,故A错误;
B.ClO3-中Cl的价层电子对数=3+$\frac{7+1-2×3}{2}$=4,含有一个孤电子对,则离子的空间构型为三角锥形,故B错误;
C.SF6中S元素化合价为+6,S原子最外层电子数是6,6+6=12,分子中S原子不满足8电子结构,故C错误;
D.SiF4中Si的价层电子对数=4+$\frac{4-1×4}{2}$=4,SO32-中S的价层电子对数=3+$\frac{6+2-2×3}{2}$=4,所以中心原子均为sp3杂化,故D正确;
故选D.
点评 本题考查分子的构型、原子杂化方式判断等知识点,侧重考查基本理论,难点是判断原子杂化方式,孤电子对个数的计算为易错点.

练习册系列答案
相关题目
16.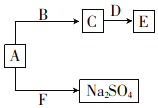 已知五种短周期元素在周期表中的相对位置如表所示.
已知五种短周期元素在周期表中的相对位置如表所示.
(1)表中五种元素金属性最强的元素为Na(填元素符号),c、e两元素形成的离子化合物c2e的电子式为 .
.
(2)c、d、e三种元素的简单离子中,半径最小的是Al3+(用元素符号表示).
(3)b、e两元素分别与a形成的最简单气态化合物的稳定性的关系为H2O>H2S(或H2S<H2O)(用化学式表示).
(4)已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成.它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
①写出物质E的化学式:NaAlO2.
②写出A与F反应的化学方程式:Na2O2+SO2=Na2SO4.
 已知五种短周期元素在周期表中的相对位置如表所示.
已知五种短周期元素在周期表中的相对位置如表所示.| a | |||||
| b | |||||
| c | d | e |
 .
.(2)c、d、e三种元素的简单离子中,半径最小的是Al3+(用元素符号表示).
(3)b、e两元素分别与a形成的最简单气态化合物的稳定性的关系为H2O>H2S(或H2S<H2O)(用化学式表示).
(4)已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成.它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
①写出物质E的化学式:NaAlO2.
②写出A与F反应的化学方程式:Na2O2+SO2=Na2SO4.
1.资料显示:O2的氧化性随溶液pH的增大逐渐减弱.室温下,某学习小组利用下图装置探究不同条件下KI与O2的反应,实验记录如下.
回答下列问题:
(1)实验③的目的是验证Cl-是否影响KI与O2的反应.
(2)实验②中发生反应的离子方程式是4I-+O2+4H+=2I2+2H2O.
(3)实验②比实验④溶液颜色深的原因是其他条件相同时,HCl是强电解质,溶液中c(H+)较醋酸大,O2的氧化性较强.
为进一步探究KI与O2的反应,用上述装置继续进行实验:
对于实验⑥的现象.甲同学猜想“pH=10时O2不能氧化I-”,他设计了下列装置进行实验以验证猜想.
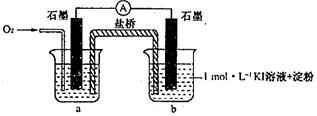
(4)烧杯a中的溶液为pH=10的KOH溶液.
(5)实验结果表明此猜想不成立.支持该结论的实验现象是:通入O2后,电流表指针偏转,烧杯b中的溶液逐渐变蓝色.
(6)乙同学向pH=10的“KOH一淀粉溶液”中滴加碘水,溶液先变蓝后迅速褪色,经检测褪色后的溶液中含有IO3-,用离子方程式表示退色的原因是3I2+6OH-=IO3-+5I-+3H2O.
(7)该小组同学对实验过程进行了整体反思,推测实验①和实验⑥的现象产生的原因分别可能是中性条件下,O2的氧化性比较弱,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.
| 序号 | 烧杯中的液体 | 5分钟后现象 |
| ① | 2mL 1mol•L-1KI溶液+5滴淀粉 | 无明显变化 |
| ② | 2mL1mol•L-1KI 溶液+5 滴淀粉+2mL0.2mol•L-1HC1 | 溶液变蓝 |
| ③ | 2mLl mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1KC1 | 无明显变化 |
| ④ | 2mL1mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1CH3COOH | 溶液变蓝,颜色 较②浅 |
(1)实验③的目的是验证Cl-是否影响KI与O2的反应.
(2)实验②中发生反应的离子方程式是4I-+O2+4H+=2I2+2H2O.
(3)实验②比实验④溶液颜色深的原因是其他条件相同时,HCl是强电解质,溶液中c(H+)较醋酸大,O2的氧化性较强.
为进一步探究KI与O2的反应,用上述装置继续进行实验:
| 序号 | 烧杯中的液体 | 5小时后现象 |
| ⑤ | 2mL混有KOH的pH=8.5的lmol•L-1KI溶液+5滴淀粉 | 溶液略变蓝 |
| ⑥ | 2mL混有KOH的pH=10的lmol•L-1KI溶液+5滴淀粉 | 无明显变化 |

(4)烧杯a中的溶液为pH=10的KOH溶液.
(5)实验结果表明此猜想不成立.支持该结论的实验现象是:通入O2后,电流表指针偏转,烧杯b中的溶液逐渐变蓝色.
(6)乙同学向pH=10的“KOH一淀粉溶液”中滴加碘水,溶液先变蓝后迅速褪色,经检测褪色后的溶液中含有IO3-,用离子方程式表示退色的原因是3I2+6OH-=IO3-+5I-+3H2O.
(7)该小组同学对实验过程进行了整体反思,推测实验①和实验⑥的现象产生的原因分别可能是中性条件下,O2的氧化性比较弱,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.
11.设NA为阿伏加德罗常数的值,下列说法错误的是( )
| A. | 16g18O2含有的中子数为10NA | B. | 1.9g1H37Cl含有的电子数为0.9NA | ||
| C. | lmolN2中共用电子对数为3NA | D. | 0.5molNH4+含有的质子数为5.5NA |
18.已知X+Y═M+N反应中的能量变化过程如图,则下列有关说法正确的是( )
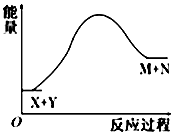

| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X和Y的总能量一定低于M和N的总能量 |

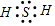
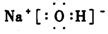 .
.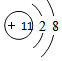 ;
; ,该物质属于离子(离子、共价)化合物,该物质溶于水会破坏离子键(离子键、共价键).
,该物质属于离子(离子、共价)化合物,该物质溶于水会破坏离子键(离子键、共价键). ,该物质属于共价(离子、共价)化合物,该物质在受热气化时化学键没有(有、没有)遭到破坏.
,该物质属于共价(离子、共价)化合物,该物质在受热气化时化学键没有(有、没有)遭到破坏.