题目内容
9.分别处于第二、第三周期的主族元素A和B,它们的离子电子层结构相差两层,已知A处于第m族,B处于第n族,A只有正化合价,则A、B的原子序数分别是( )| A. | m、n | B. | 3、7 | C. | m-2、10-n | D. | m+2、n+10 |
分析 A是第二周期主族元素,处于第m族,有2个电子层,最外层电子数为m,B是第三周期元素,处于第n族,有3个电子层,最外层电子数为n,K层排满容纳2个电子、L层排满容纳8个电子,根据各层电子数计算核外电子总数,从而可知A、B的原子序数.
解答 解:A是第二周期主族元素,处于第m族,有2个电子层,最外层电子数为m,故其核外电子总数=原子序数=m+2;
B是第三周期元素,处于第n族,有3个电子层,最外层电子数为n,故其核外电子总数=原子序数=2+8+n=n+10,
故选D.
点评 本题考查位置、结构与性质关系的应用,题目难度不大,明确原子结构、原子序数=核外电子总数为解答关键,注意熟练掌握原子结构与元素周期表达到关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
17.化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )
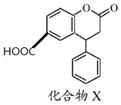

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和NaHCO3溶液反应 | |
| C. | 化合物X可以由 和 和 通过酯化反应得到 通过酯化反应得到 | |
| D. | 1 mol化合物X最多能与3 molNaOH反应 |
14.某中性有机物在酸性条件下可以水解生成相对分子质量相同的A和B,A是中性物质,B可以与碳酸钠反应放出气体,该有机物是( )
| A. | CH3COOC3H7 | B. | CH3COOC2H5 | C. | CH3COONa | D. | CH3CH2Br |
1.NA表示阿伏伽德罗常数,下列有关说法正确的是( )
| A. | 32gO2和O3的混合物中,所含氧原子数为2NA | |
| B. | 标准状况下,22.4LCl2与水反应,转移电子数为2NA | |
| C. | 标准状况下,3.36L辛烷中,所含碳原子数为1.5NA | |
| D. | 含1molFeCl3的饱和溶液,逐滴加入沸水中,完全形成Fe(OH)3胶体,胶粒数为NA |
18.25℃时,将10mL质量分数为50%(密度1.4g/mL)的硫酸稀释成100mL,下列说法正确的是( )
| A. | 纯硫酸的摩尔质量为98 | |
| B. | 上述100mL稀硫酸中含溶质14g | |
| C. | 上述稀释过程所需要的蒸馏水为90mL | |
| D. | 质量分数为50%的硫酸物质的量浓度为7.14mol/L |


 ;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.
;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O. 有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.