题目内容
16.将氯水分别滴加到盛有下列物质的试管中,没有明显现象的是( )| A. | 紫色石蕊溶液 | B. | 石灰石粉末 | C. | 硝酸银溶液 | D. | 硫酸钠溶液 |
分析 氯气与水发生:Cl2+H2O=HCl+HClO,HClO具有弱酸性、强氧化性、漂白性以及不稳定性,氯水中含有Cl2、HClO和H2O等分子,以此解答该题,
A.氯水中的盐酸遇到紫色石蕊试液会使之变红色,氯水中的次氯酸具有漂白作用可以使红色褪去;
B.石灰石粉末中加入氯水,氯水中的盐酸和碳酸钙反应生成二氧化碳气体;
C.氯水中含有Cl-离子,滴入到硝酸银溶液中有AgCl沉淀生成;
D.硫酸钠溶液中滴入氯水无反应现象发生.
解答 解:A.氯水呈酸性,并具有氧化性和漂白性,加入紫色石蕊溶液中,溶液颜色先变红色后褪色,故A错误;
B.氯水中含有盐酸,滴入到石灰石粉末中发生反应,生成二氧化碳气体,CaCO3+2HCl=CaCl2+CO2↑+H2O,溶液中冒气泡,故B错误;
C.氯水中含有Cl-离子,滴入到硝酸银溶液中有AgCl沉淀生成,Ag++Cl-=AgCl↓,故C错误;
D.氯水加入到硫酸钠溶液中,氯水中各成分和硫酸钠都不发生反应,所以滴入没有明显现象,故D正确.
故选D.
点评 本题考查氯水的组成和性质,题目难度中等,解答本题明确氯水的成分和物质的反应现象是关键,学习中注重相关基础知识的积累.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
17.下列物质在水溶液中没有漂白作用的是( )
| A. | Cl2 | B. | Na2O2 | C. | NaOH | D. | SO2 |
7.氯化铜的水溶液中存在下列可逆反应:下列方法能使蓝色的氯化铜溶液变成黄绿色的是( )
[Cu(H2O)4]2++4Cl-?[CuCl4]2-+4H2O
淡蓝色 黄绿色.
[Cu(H2O)4]2++4Cl-?[CuCl4]2-+4H2O
淡蓝色 黄绿色.
| A. | 加蒸馏水 | B. | 加浓盐酸 | C. | 加AgNO3溶液 | D. | 加氢氧化钠溶液 |
4.碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一.碳酸氢钠(NaHCO3)属于( )
| A. | 氧化物 | B. | 酸 | C. | 碱 | D. | 盐 |
11.下列物质在空气中不易变质的是( )
| A. | 钠 | B. | 氧化钙 | C. | 食盐 | D. | 石灰水 |
5.下列实验操作中错误的是( )
| A. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 使用容量瓶前检查它是否漏水 | |
| D. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 |
6.X、Y、Z、W是原子序数依次增大的四种短周期主族元素,已知Z的最高正价与最低负价的代数和为4,Y能形成两种常见的液体二元化合物M、Q,其中M是生物生存必需的物质,X能形成多种单质,其中有两种单质硬度差异极大,下列说法中正确的是( )
| A. | 元素X只能形成一种氢化物 | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(X)>r(Y) | |
| C. | 化合物Q中存在两种类型的共价键 | |
| D. | X与Z形成的化合物在熔融状态下能导电 |
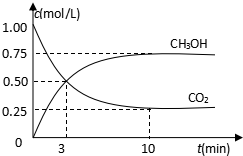 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在485℃时,在体积为1L的密闭容器中,充入1ol CO2和3mol H2,一定条件下发生反应合成甲醇:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在485℃时,在体积为1L的密闭容器中,充入1ol CO2和3mol H2,一定条件下发生反应合成甲醇: