题目内容
7.常温下,甲、乙、丙三位同学用实验确定某酸HA是弱电解质的方案分别是:甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质.
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL.
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质.
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,分析表中数据可以说明HA是弱电解质.
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l.
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
分析 (1)弱电解质的电离是可逆的,不能完全电离;
(2)精确取pH=1的HA溶液和稀盐酸个10.00mL,用酸式滴定管;
(3)弱酸在水溶液里部分电离,所以氢离子浓度小于酸浓度;酸和锌反应时生成氢气,反应速率和氢离子浓度成正比,根据生成氢气的反应速率确定酸的强弱;
(4)若酸为强酸,等体积等浓度混合时pH=7;而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度大于0.1mol/L;
(5)由③组实验结果可知,混合后为HA与NaA的混合液,pH=7,酸的电离等于盐的水解.
解答 解:(1)配制0.1mol/L的HA酸溶液100mL,弱电解质的电离是可逆的,不能完全电离,用pH试纸测出该溶液的pH值,如果是pH>1即为弱酸,pH=1即为强酸,
故答案为:>;
(2)精确取pH=1的HA溶液和稀盐酸个10.00mL,用酸式滴定管,
故答案为:酸式滴定管;
(3)pH相等的一元酸,弱酸的浓度大于强酸,等体积等PH的醋酸和盐酸稀释相同倍数时,醋酸中氢离子浓度大于盐酸,分别和锌反应时,弱酸生成氢气的反应速率大于强酸,故B正确,
故答案为:B;
(4)若酸为强酸,等体积等浓度混合时pH=7;而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度大于0.1mol/L,
故答案为:>;
(5)由③组实验结果可知,等体积混合后,得到同浓度HA与NaA的混合液,pH<7,说明酸的电离程度大于盐的水解程度,
故答案为:强.
点评 本题考查酸碱混合溶液pH的计算及离子浓度大小的比较,题目难度中等,明确酸碱混合后溶液中的溶质、盐类水解原理及弱酸的浓度与pH的关系即可解答,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
11.某人按下列方法测定样品中Na2O2的含量:城区一定量样品溶于足量的水,Na2O2+2H2O═2NaOH+H2O2,H2O2$\frac{\underline{\;NaOH\;}}{\;}$H2O+$\frac{1}{2}$O2.根据生成O2的量计算样品中Na2O2的纯度,他仔细实验多次,得到Na2O2含量均明显低于实际含量,这是因为( )
| A. | 称量错误 | |
| B. | H2O2分解不完全 | |
| C. | Na2O2转化为Na0H和H2O2的反应不完全 | |
| D. | 装置漏气 |
15.下列图示与对应的叙述相符的是( )
| A. |  表示0.001 mol•L一1盐酸滴定0.001 mol•L一1NaOH溶液的滴定曲线 | |
| B. | 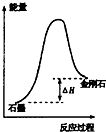 所示,石墨的熔点比金刚石低 | |
| C. | 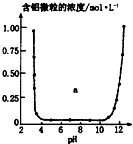 表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3 | |
| D. | 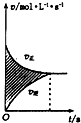 所示,图中的阴影部分面积的含义是[v(正)-v(逆))] |
2.下列说法正确的是( )
| A. | 氨水导电能力比BaSO4的水溶液强,所以氨水是强电解质,BaSO4是弱电解质 | |
| B. | 已知H2C2O4是弱酸,其电离方程式为:H2C2O4?2H++C2O42- | |
| C. | 若反应C(s)+CO2(g)?2CO(g)在常温下不能自发,则该反应的△H>0 | |
| D. | 工业合成氨温度控制在500℃,目的是为了提高产率 |
19.下列图示与对应的叙述相符的是( )
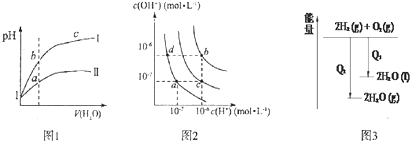

| A. | 图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2中纯水仅升高温度,就可以从a点变到c点 | |
| C. | 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 | |
| D. | 图3表示氢气与氧气反应中的能量变化 |
16.电解质是一类在水溶液里或熔融状态下能够导电的化合物.下列物质属于电解质的是( )
| A. | Fe | B. | NaCl | C. | SiO2 | D. | KNO3溶液 |
17. 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.往溶液滴加NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.往溶液滴加NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.往溶液滴加NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.往溶液滴加NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )| A. | 溶液中的阳离子只有H+、NH4+、Mg2+、Al3+ | |
| B. | 溶液中n(NH4+)=0.2mol | |
| C. | 溶液中一定不含CO32-,可能含有SO42-和NO3- | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |