题目内容
17. 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.往溶液滴加NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.往溶液滴加NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )| A. | 溶液中的阳离子只有H+、NH4+、Mg2+、Al3+ | |
| B. | 溶液中n(NH4+)=0.2mol | |
| C. | 溶液中一定不含CO32-,可能含有SO42-和NO3- | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
分析 加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+,则不能含有CO32-;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必须存在阴离子,所以一定还有SO42-.结合图象中各阶段消耗的氢氧化钠,计算溶液中n(H+)、n(Mg2+)、n(Al3+)、n(NH4+),据此解答.
解答 解:加入NaOH溶液,产生白色沉淀,说明不存在Fe3+;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必须存在阴离子,所以一定还有SO42-;
由图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.1mol,则n(H+)=0.1mol;
第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7mol-0.5mol=0.2mol,则n(NH4+)=0.2mol;
最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8mol-0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol;
第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5mol-0.1mol=0.4mol,则n(Mg2+)=(0.4mol-0.1mol×3)÷2=0.05mol,
A.由上述分析可知,溶液中的阳离子只有H+、Mg2+、Al3+、NH4+,故A正确;
B.由上述分析可知,溶液中n(NH4+)=0.2mol,故B正确;
C.由上述分析可知,溶液中一定不含CO32-,可能含有SO42-、NO3-,故C正确;
D.由上述分析可知,溶液中n(H+):n(Al3+):n(Mg2+)=0.1mol:0.1mol:0.05mol=2:2:1,故D错误,
故选D.
点评 本题考查离子共存、反应图象识别以及离子反应有关计算等,题目难度中等,对学生的综合能力提出了更高的要求,有利于培养学生的逻辑思维能力和发散思维能力,注意把握图象中各个阶段发生的反应.

甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质.
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL.
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质.
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,分析表中数据可以说明HA是弱电解质.
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l.
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
| A. | 44 g CO2的体积是22.4 L | |
| B. | NH3的摩尔质量是17g/mol | |
| C. | 100 mL 1 mol/L NaCl溶液中含有1 mol Cl- | |
| D. | 标准状况下,11.2 L H2O中含有3.01×1023个水分子 |
 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.有关说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.有关说法正确的是( )| A. | 等浓度的两种酸其酸性相同 | |
| B. | 两种酸都能与溴水发生加成反应 | |
| C. | 鞣酸分子与莽草酸分子相比多了两个碳碳双键 | |
| D. | 鞣酸能与Fe3+发生显色反应,而莽草酸不能 |
| A. | 范德华力 | B. | 离子键 | C. | 共价键 | D. | 金属键 |
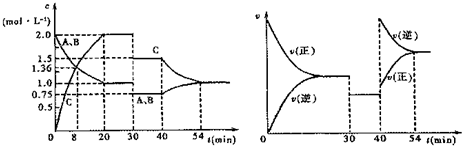
| A. | 反应方程式中的x=1 | |
| B. | 该反应为放热反应 | |
| C. | 30 min时改变的条件是加入催化剂 | |
| D. | 前30 min内A的反应速率为0.05 mol/(L•min) |
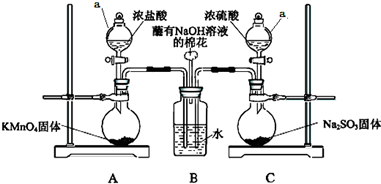 某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验.
某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验.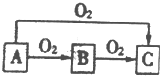 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物)
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物)