题目内容
2.下列说法正确的是( )| A. | 氨水导电能力比BaSO4的水溶液强,所以氨水是强电解质,BaSO4是弱电解质 | |
| B. | 已知H2C2O4是弱酸,其电离方程式为:H2C2O4?2H++C2O42- | |
| C. | 若反应C(s)+CO2(g)?2CO(g)在常温下不能自发,则该反应的△H>0 | |
| D. | 工业合成氨温度控制在500℃,目的是为了提高产率 |
分析 A.强、弱电解质的本质区别在于电解质是否完全电离,与溶液导电性没有必然关系;
B.草酸为二元弱酸,在溶液中部分电离,主要以第一步为主,其电离方程式分步书写;
C.不能自发进行的反应△H-T△S>0;
D.工业合成氨温度控制在500℃,主要是考虑催化剂的催化活性及反应速率.
解答 解:A.一水合氨在溶液中部分电离,则一水合氨为弱电解质,且氨水为混合物,则氨水既不是电解质,也不是非电解质;BaSO4投入水中,导电性较弱,是因为硫酸钡的溶解度小,离子浓度低,溶解的硫酸钡完全电离,硫酸钡是强电解质,故A错误;
B.已知H2C2O4是弱酸,则电离方程式分步书写,主要以第一步为主,其电离方程式为:H2C2O4?H++HC2O4-,故B错误;
C.该反应的△S>0,若不能自发进行,△H-T△S>0,则△H>0,故C正确;
D.合成氨反应为放热反应,采用500℃的温度,不利于平衡向正方向移动,不利于反应产率,主要是考虑催化剂的活性和反应速率,故D错误;
故选C.
点评 本题考查较为综合,涉及弱电解质的电离平衡、化学平衡的影响因素、反应热与焓变等知识,主要掌握化学平衡及其影响因素,明确弱电解质的电离平衡及强弱电解质的区别.

练习册系列答案
相关题目
6.常温下,氮的氧化物(NOx)中除五氧化二氮为固体外,其余均为气体.五氧化二氮的熔点为30℃,则等质量的N2O、N0、N2O5三种物质在常温下体积的大小顺序是( )
| A. | N2O>NO>N2O5 | B. | NO>N2O>N2O5 | C. | N2O5>NO>N2O | D. | N2O5>N2O>NO |
10.海水中含有多种元素,开发利用这些资源是科学研究的重要课题.图为海水利用的部分过程,下列有关说法正确的是( )
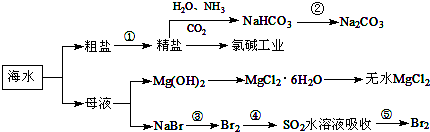

| A. | 要实现反应②可向NaHCO3溶液中加入过量石灰水 | |
| B. | 氯碱工业中采用阴离子交换膜提高产品纯度 | |
| C. | MgCl2溶液加热蒸干可得无水MgCl2 | |
| D. | 溴元素在反应③、⑤中均被氧化,在反应④中被还原 |
17.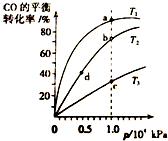 用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
 用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A. | 温度:T1>T2>T3 | B. | 正反应速率:v(a)>v(c) v(b)>v(d) | ||
| C. | 平衡常数:K(a)>K(b) K(b)=K(d) | D. | 平均摩尔质量:M(a)>M(c) M(b)<M(d) |
7.常温下,甲、乙、丙三位同学用实验确定某酸HA是弱电解质的方案分别是:
甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质.
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL.
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质.
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,分析表中数据可以说明HA是弱电解质.
(1)甲的方案中,说明HA是弱电解质的理由是测得溶液的pH>1(填“>”、“<”或“=”).
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l.
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质.
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL.
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质.
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,分析表中数据可以说明HA是弱电解质.
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l.
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
14. 氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是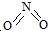 和
和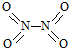 .实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.
.实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.
(1)写出N2O4转化为NO2的热化学方程式:N2O4(g)?2NO2(g)△H=+57 kJ•mol-1
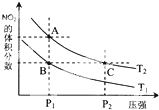
(2)对反应N2O4(g)?2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为0.0025mol•(L•s)-1
②n3=n4(填“>”、“<”或“=”),该反应的平衡常数K的值为2.8,升高温度后,反应2NO2?N2O4的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.
 氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是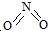 和
和 .实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.
.实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.(1)写出N2O4转化为NO2的热化学方程式:N2O4(g)?2NO2(g)△H=+57 kJ•mol-1
(2)对反应N2O4(g)?2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
②n3=n4(填“>”、“<”或“=”),该反应的平衡常数K的值为2.8,升高温度后,反应2NO2?N2O4的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.
11.用质量分数为98%的浓硫酸(ρ=1.84g•cm-3)配制240mL1.84mol•L-1的稀硫酸.下列叙述正确的是( )
| A. | 要用到的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管和容量瓶 | |
| B. | 量取浓硫酸的体积为24 mL | |
| C. | 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,不断搅拌并冷却至室温 | |
| D. | 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容 |
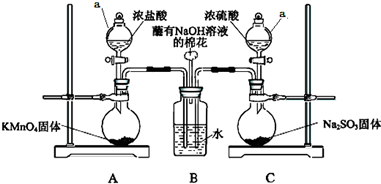 某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验.
某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验.