题目内容
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B、常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA |
| C、标准状况下,11.2LCCl4中含有分子的数目为0.5NA |
| D、1.0L 0.1 mol?L-1 AlCl3溶液中所含的Al3+离子数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、氯气溶于水和水反应是可逆反应;
B、依据元素守恒计算氧原子数;
C、标准状况四氯化碳不是气体;
D、铝离子水溶液中水解减少.
B、依据元素守恒计算氧原子数;
C、标准状况四氯化碳不是气体;
D、铝离子水溶液中水解减少.
解答:
解:A、氯气溶于水和水反应是可逆反应,不能进行彻底,0.1molCl2溶于水,转移的电子数目小于0.1NA,故A错误;
B、依据元素守恒计算氧原子数,3.2gO2和O3混合气体中含有的氧原子数目=
×NA=0.2NA,故B正确;
C、标准状况四氯化碳不是气体,11.2LCCl4中物质的量不是0.5mol,故C错误;
D、铝离子水溶液中水解减少,1.0L 0.1 mol?L-1 AlCl3溶液中所含的Al3+离子数小于0.1NA,故D错误;
故选B.
B、依据元素守恒计算氧原子数,3.2gO2和O3混合气体中含有的氧原子数目=
| 3.2g |
| 16g/mol |
C、标准状况四氯化碳不是气体,11.2LCCl4中物质的量不是0.5mol,故C错误;
D、铝离子水溶液中水解减少,1.0L 0.1 mol?L-1 AlCl3溶液中所含的Al3+离子数小于0.1NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件应用,盐类水解分析判断,注意氯气和水反应是可逆反应,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各组离子,一定能在指定环境中大量共存的是( )
| A、含有大量I-离子的溶液中:Cl?、Fe3+、Al3+、Cu2+ |
| B、使甲基橙变红的溶液中:Fe3+、Na+、SO42-、NO3- |
| C、由水电离出的c(H+)=10-12 mol?L-1的溶液中:Na+、Ba2+、AlO2-、HCO3- |
| D、加入Al能放出大量H2的溶液中:NH4+、K+、SO32?、C1? |
对于可逆反应N2+3H2
2NH3达到平衡时,下列说法正确的是( )
| ||
| 高温高压 |
| A、N2、NH3、H2三种物质的浓度一定相等 |
| B、N2、H2全部变成NH3 |
| C、反应混合物各组分的浓度不再变化 |
| D、反应已经停止 |
下列试剂的保存不正确的是( )
| A、漂白粉必须密封保存 |
| B、液溴用一层水封盖再密封保存 |
| C、少量金属钠保存在煤油中 |
| D、新制氯水用无色的广口瓶保存 |
太阳能电池常用的主要材料是( )
| A、高纯硅 | B、活性炭 |
| C、铁合金 | D、金属钠 |
常温下,能被浓硝酸钝化的金属是( )
| A、Mg | B、Fe | C、Cu | D、Al |
在下列物质中,属于离子化合物的是( )
| A、HCl |
| B、H2O |
| C、NaCl |
| D、Cl2 |
某溶液中加入铝片有氢气产生,则在该溶液中一定能够大量共存的离子组是( )
| A、NH4+、Ba2+、Cl-、HCO3- |
| B、Na+、K+、SO42-、Cl- |
| C、K+、Na+、Ba2+、Cl- |
| D、SO42-、CH3COO-、Al3+、Mg2+ |
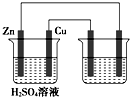 如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )
如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )| A、铜在原电池中作负极,在电镀池中作阳极 |
| B、原电池溶液增加的质量比电镀池阴极增加的质量大 |
| C、锌棒每减少0.65 g,导线上转移的电子约为1.204×1022个 |
| D、电路中电子的移动方向是从Zn沿导线到电镀池的铜极,再经过溶液到铁棒 |