题目内容
下列液体均处于25℃,有关叙述正确的是( )
| A、某物质的溶液pH<7,则该物质属于酸或强酸弱碱盐 |
| B、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
| D、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
考点:pH的简单计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A、常温下,酸溶液、强酸弱碱盐、部分酸式盐的pH<7;
B、根据pH=-lgc(H+)来计算回答;
C、pH=5.6的CH3COOH与CH3COONa混合溶液中酸的电离程度大于盐的水解程度,溶液中存在电荷守恒;
D、氯离子对氯化银的沉淀溶解平衡起到抑制作用.
B、根据pH=-lgc(H+)来计算回答;
C、pH=5.6的CH3COOH与CH3COONa混合溶液中酸的电离程度大于盐的水解程度,溶液中存在电荷守恒;
D、氯离子对氯化银的沉淀溶解平衡起到抑制作用.
解答:
解:A、常温下,酸溶液、强酸弱碱盐的pH<7,此外硫酸氢钠是强酸强碱盐,溶液显示酸性,故A错误;
B、根据pH=-lgc(H+),pH=4.5的番茄汁中c(H+)是10-4.5,pH=6.5的牛奶中c(H+)是10-6.5,pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍,故B正确;
C、pH=5.6的CH3COOH与CH3COONa混合溶液中,酸的电离程度大于盐的水解程度,c(H+)>c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)<c(CH3COO-),故C错误;
D、氯离子对氯化银的沉淀溶解平衡起到抑制作用,氯离子浓度越大,抑制程度越大,同浓度的CaCl2和NaCl溶液中的氯离子浓度前者较大,AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相等,故D错误.
故选B.
B、根据pH=-lgc(H+),pH=4.5的番茄汁中c(H+)是10-4.5,pH=6.5的牛奶中c(H+)是10-6.5,pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍,故B正确;
C、pH=5.6的CH3COOH与CH3COONa混合溶液中,酸的电离程度大于盐的水解程度,c(H+)>c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)<c(CH3COO-),故C错误;
D、氯离子对氯化银的沉淀溶解平衡起到抑制作用,氯离子浓度越大,抑制程度越大,同浓度的CaCl2和NaCl溶液中的氯离子浓度前者较大,AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相等,故D错误.
故选B.
点评:本题考查学生溶液中离子浓度的大小比较以及pH有关计算、沉淀溶解平衡移动的影响因素等知识,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
对于可逆反应N2+3H2
2NH3达到平衡时,下列说法正确的是( )
| ||
| 高温高压 |
| A、N2、NH3、H2三种物质的浓度一定相等 |
| B、N2、H2全部变成NH3 |
| C、反应混合物各组分的浓度不再变化 |
| D、反应已经停止 |
在下列物质中,属于离子化合物的是( )
| A、HCl |
| B、H2O |
| C、NaCl |
| D、Cl2 |
某溶液中加入铝片有氢气产生,则在该溶液中一定能够大量共存的离子组是( )
| A、NH4+、Ba2+、Cl-、HCO3- |
| B、Na+、K+、SO42-、Cl- |
| C、K+、Na+、Ba2+、Cl- |
| D、SO42-、CH3COO-、Al3+、Mg2+ |
关于合理饮食有利于健康的下列说法正确的是( )
| A、没有水就没有生命 |
| B、饮用水越纯净越好 |
| C、养成良好的饮食习惯,只吃蔬菜,水果等碱性食物 |
| D、调味剂和营养剂加的越多越好 |
短周期主族元素A、B、C、D、E的原子序数依次递增,A的单质在常温下呈气态,D元素的单质既能与盐酸反应也能与NaOH溶液反应,B、C、E原子的最外层电子数之和为13,E原子的最外层电子数是B原子内层电子数的3倍或是C原子最外层电子数的3倍.下列说法正确的是( )
| A、原子半径的大小顺序:r(B)>r(C)>r(A) |
| B、元素E的氧化物的水化物一定是强酸 |
| C、D单质在一定条件下可以与氧化铁发生置换反应 |
| D、工业上常用电解元素C、D的氯化物来制取它们的单质 |
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )

| A、CO2(g)+H2(g)?CO(g)+H2O(g);△H>0 |
| B、CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g);△H<0 |
| C、CH3CH2OH(g)?CH2=CH2(g)+H2O(g);△H>0 |
| D、2C6H5CH2CH3(g)+O2(g)?2C6H5CH═CH2(g)+2H2O(g);△H<0 |
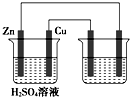 如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )
如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )| A、铜在原电池中作负极,在电镀池中作阳极 |
| B、原电池溶液增加的质量比电镀池阴极增加的质量大 |
| C、锌棒每减少0.65 g,导线上转移的电子约为1.204×1022个 |
| D、电路中电子的移动方向是从Zn沿导线到电镀池的铜极,再经过溶液到铁棒 |
20mL 1mol/L NaCl溶液和40mL 0.5mol/L MgCl2溶液混合之后(体积的变化忽略不计),混合液中Cl-的物质的量浓度为( )
| A、0.5 mol/L |
| B、0.6 mol/L |
| C、1 mol/L |
| D、2 mol/L |