题目内容
19.氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:(1)已知:2NO2(g)?N2O4(g)△H1 2NO2(g)?N2O4(l)△H2
下列图1能量变化示意图中,正确的是(选填字母)A.
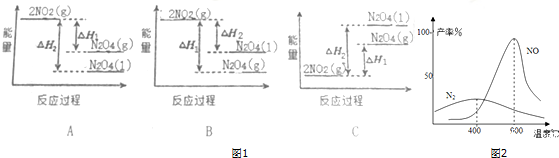
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图2)
温度较低时以生成N2为主,温度高于900℃时,NO产率下降的原因是氨气转化为一氧化氮的反应为放热反应.
(3)火箭升空需要高能的燃料,经常是用四氧化二氮和联氨(N2H4)作为燃料,工业上利用氨气和氢气可以合成氨气,氨又可以进一步制备联氨等.
已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
NO2(g)?$\frac{1}{2}$N2O4(g)△H=-26.35kJ•mol-1
①写出气态联氨在气态四氧化二氮中燃烧生成氮气和水蒸气的热化学方程式:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0 kJ/mol.
②用氨和次氯酸钠按一定物质的量之比混合反应可生成联氨,该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O.
分析 (1)将NO2(g)转化为N2O4(g)的反应为放热反应,同种物质气态时能量比液态时能量高;
(2)根据图象可知温度低时生成氮气,温度高时生成NO,但该反应为放热反应,则温度高于900℃时,NO产率下降;
(3)①根据盖斯定律,由已知热化学方程式乘以合适的系数进行适当的加减,反应热也乘以相应的系数进行相应的加减;
②根据在反应中氨气做还原剂被氧化,次氯酸钠做氧化剂被还原来分析产物.
解答 解:(1)将NO2(g)转化为N2O4(g)的反应为放热反应,将N2O4(g)转化为N2O4(l)液为放热反应,所以在图象中该反应的反应物的总能量比生成物的总能量高,同种物质气态变液态会放出热量,即液态时能量比气态时能量低,则N2O4(l)具有的能量比N2O4(g)具有的能量低,图象A符合,故A正确;
故答案为:A;
(2)根据图象可知温度低时,氨气与氧气反应生成氮气;温度高时生成NO,但该反应为放热反应,当温度高于900℃时,温度越高,反应逆向进行的程度越大,则NO产率越小;
故答案为:N2;氨气转化为一氧化氮的反应为放热反应;
(3)①已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1②
NO2(g)?$\frac{1}{2}$N2O4(g)△H=-26.35kJ•mol-1③
根据盖斯定律,②×2-①-③×2得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) 故△H=2×(-534.0kJ•mol-1)-67.7kJ•mol-1-2×(-26.35kJ•mol-1)=-1083.2kJ•mol-1;
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0 kJ/mol;
②氨和次氯酸钠反应时,氨气中的氮元素被氧化为N2H4,NaClO中的氯元素被还原为NaCl,故化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O.
点评 本题考查了能量变化图的分析、化学平衡移动的影响因素、盖斯定律的计算,题目难度中等,题目侧重于考查学生的综合运用能力,注意基础知识的积累掌握是关键.

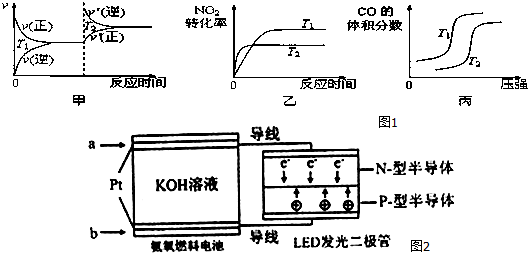
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.
4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,如图1图象正确的是乙(填代号).
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是bc(填字母代号).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率降低(填“升高”或“降低”),△H<0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0 kJ•mol-1.
(4)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液.
电池反应为:4NH3+3O2=2N2+6H2O;
请写出通入图2中a气体一极的电极反应式为2NH3+6OH--6e-=N2+6H2O;每消耗3.4g NH3转移电子的物质的量为0.6mol.
| A. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| B. | 活化分子间的碰撞一定能导致化学键断裂 | |
| C. | 在FeCl3+3KSCN═Fe(SCN)3+3KCl平衡体系中,加入KCl固体,平衡逆向移动 | |
| D. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向熵增的方向转变的倾向 |
(1)已知:
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
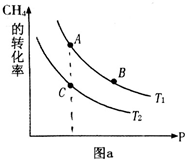
(2)在容积可变的密闭容器中充入1mol CO ( g ) 和2molH2 ( g )生成CH3OH( g ),H2的平衡转化率随温度(T)、压强(P)的变化如图1所示.
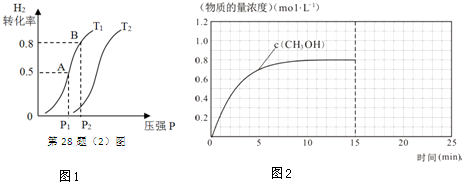
①该反应的△S<0,图中的T1<T2(填“<”、“>”或“=”).
②当达到平衡状态A 时,容器的体积为2L,此时该反应的平衡常数为4,若达到平衡状态B 时,则容器的体积V(B)=0.4L.
③在该容器中,下列措施可增加甲醇产率的是B.
A.升高温度 B.从平衡体系中及时分离CH3OH
C.充入He D.再充入0.5mol CO和1mol H2
(3)在容积固定为2L的密闭容器中充入2molCO( g )和6molH2( g )生成CH3OH( g ),反应时间与物质的量浓度的关系如图2所示,则前10分钟内,氢气的平均反应速率为0.16mol•L-1•min-1;若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图2中画出15-25分钟c (CO)的变化曲线.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期、第ⅦA族.
(2)表中元素原子半径最大的是(填元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
(5)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,
联氨分子的电子式为①
 ,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O .
,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O . | A. | Fe2O3 是还原剂 | B. | CO是氧化剂 | ||
| C. | 氧化剂得到6mol电子 | D. | 还原剂失去8mol电子 |
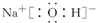 .
. .
. 氢气、甲醇是优质的清洁燃料,可制作燃料电池.
氢气、甲醇是优质的清洁燃料,可制作燃料电池.