题目内容
16.①84消毒液(有效成分NaClO)和洁厕灵(含有盐酸成分)不能混用,请用离子方程式解释原因ClO-+Cl-+2H+=Cl2↑+H2O.②某些防治碘缺乏病的碘添加剂是KIO3(如加碘盐),可用盐酸酸化的淀粉碘化钾混合液检验食盐是否加碘,其反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O.
分析 ①次氯酸根离子具有强的氧化性,能够氧化氯离子生成氯气;
②碘酸根离子具有强的氧化性,能够氧化碘离子生成单质碘.
解答 解:①次氯酸根离子与氯离子在酸性环境下反应生成氯气和水,离子方程式:ClO-+Cl-+2H+=Cl2↑+H2O;
故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
②碘酸根离子与碘离子在酸性环境下反应生成单质碘和水,离子方程式:IO3-+5I-+6H+=3I2+3H2O;
故答案为:IO3-+5I-+6H+=3I2+3H2O.
点评 本题考查了离子方程式的书写,侧重考查氧化还原反应的离子方程式书写,明确物质的性质是解题关键,注意离子反应遵循得失电子守恒、原子个数守恒规律,题目难度中等.

练习册系列答案
相关题目
6.下列有机化合物的分类不正确的是( )
| A. |  不饱和烃 | B. |  芳香族化合物 | C. |  醇 醇 | D. |  苯的同系物 |
7.下列各种符合题设环境的溶液中,能够大量共存的离子组是( )
| A. | 碱性溶液中:Mg2+、Fe3+、SO42-、Cl- | |
| B. | 酸性溶液中:NH4+、Na+、ClO-、SO42- | |
| C. | 透明溶液中:MnO4-、K+、Na+、NO3- | |
| D. | 滴入KSCN溶液显红色的溶液中:Na+、K+、SO42-、OH- |
4.阿魏酸在食品、医药等方面有若广泛用途.一种合成阿魏酸的反应可表示为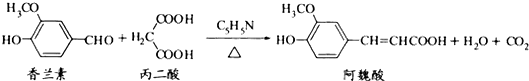
下列说法正确的是( )
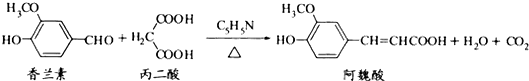
下列说法正确的是( )
| A. | 与香兰素互为同分异构体,分子中有5种不同化学环境的氢,且能发生银镜反应的酚类化合物有2种 | |
| B. | 香兰素、阿魏酸均可与NaHCO3、NaOH溶液反应 | |
| C. | 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 | |
| D. | 香兰素、阿魏酸均可与溴水反应,且反应类型完全相同 |
11.反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )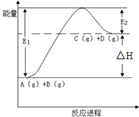

| A. | 该反应是放热反应 | |
| B. | 加入催化剂后,反应加快,△H减小 | |
| C. | 反应物的总键能小于生成物的总键能 | |
| D. | 反应达到平衡时,升高温度,A的转化率增大 |
1.某有机物分子中含有n个-CH2-,m个-CH-,a个-CH3,其余为-OH,则分子中-OH的个数为( )
| A. | m+2-a | B. | n+m+a | C. | 2n+3m-a | D. | m+2n+2-a |
5.下表是元素周期表的一部分,回答下列问题:
(1)在这些元素中,F(用元素符号填写,下同)是最活泼的非金属元素;Ar是最不活泼的元素.
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;能形成两性氢氧化物的元素是Al.
(3)从⑤到⑪的元素中,Cl原子半径最小,写出③形成的氢化物的电子式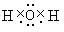 .
.
(4)⑥、⑩的最高价氧化物分别属于离子、共价型化合物(填离子,共价)
(5)比较⑤与⑥的化学性质,钠更活泼,试用实验证明(简述简单操作、主要现象和结论)取少量金属钠和金属镁,都投入冷水中,金属钠和冷水剧烈反应,生成无色气体,钠迅速消失. 而镁和冷水几乎不反应,无明显现象,证明了金属钠比金属镁活泼.
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ○ |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;能形成两性氢氧化物的元素是Al.
(3)从⑤到⑪的元素中,Cl原子半径最小,写出③形成的氢化物的电子式
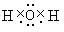 .
.(4)⑥、⑩的最高价氧化物分别属于离子、共价型化合物(填离子,共价)
(5)比较⑤与⑥的化学性质,钠更活泼,试用实验证明(简述简单操作、主要现象和结论)取少量金属钠和金属镁,都投入冷水中,金属钠和冷水剧烈反应,生成无色气体,钠迅速消失. 而镁和冷水几乎不反应,无明显现象,证明了金属钠比金属镁活泼.
8.钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤为:
TiO2-→TiCl4$\stackrel{酶/800℃/Ar}{→}$Ti
已知:①C(s)+O2(g)═CO2(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H3
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H为( )
TiO2-→TiCl4$\stackrel{酶/800℃/Ar}{→}$Ti
已知:①C(s)+O2(g)═CO2(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H3
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H为( )
| A. | △H3+2△H1+2△H2 | B. | △H3+2△H1+△H2 | C. | △H3+2△H1-△H2 | D. | △H3+2△H1-2△H2 |