题目内容
6.下列有机化合物的分类不正确的是( )| A. |  不饱和烃 | B. |  芳香族化合物 | C. |  醇 醇 | D. |  苯的同系物 |
分析 A.含有有双键、三键、苯环的烃是不饱和烃;
B.含有苯环的化合物成为芳香族化合物;
C.醇是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物;
D.苯的同系物符合:①只有一个苯环;②侧链为烷基;③具有通式CnH2n-6(n≥6).
解答 解:A. 中含有苯环和碳碳双键,是不饱和烃,故A正确;
中含有苯环和碳碳双键,是不饱和烃,故A正确;
B. 中含有苯环,属于芳香族化合物,故B正确;
中含有苯环,属于芳香族化合物,故B正确;
C. 是芳香烃侧链中的氢原子被羟基取代而成的化合物,属于醇,故C正确;
是芳香烃侧链中的氢原子被羟基取代而成的化合物,属于醇,故C正确;
D.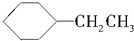 中不含苯环,不是苯的同系物,属于环烷烃,故D错误;
中不含苯环,不是苯的同系物,属于环烷烃,故D错误;
故选D.
点评 本题主要考查有机物的分类、结构,比较基础,侧重于对常见有机物类别的结构特点的分析,注意酚类与芳香醇的区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列实验设计、操作或实验现象不合理的是( )
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸后,再做银镜反应实验或与新制Cu(OH)2共热的实验 | |
| C. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入稀硝酸酸化,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
1.下列各组粒子中粒子半径由小到大的是( )
| A. | O2- Na+Mg2+Al3+ | B. | O Cl S P | ||
| C. | K+ Mg2+ Al3+ H+ | D. | A l3+Mg2+ Ca2+ F- |
11.下列说法中,不正确的是( )
| A. | 由于蒸发溶剂而析出晶体后的溶液仍为饱和溶液 | |
| B. | 在饱和溶液中,溶质的溶解速率等于结晶速率 | |
| C. | 任何物质的饱和溶液升高温度时,都变成不饱和溶液 | |
| D. | 溶质刚开始溶解时的溶液为不饱和溶液 |
18.下列叙述正确的是( )
| A. | 电子的能量越低,运动区域离核越远 | |
| B. | 当M层是最外层时,最多可排布18个电子 | |
| C. | 稀有气体元素原子的最外层都排有8个电子 | |
| D. | 核外电子的分层排布即是核外电子的分层运动 |
15. 以下元素均为短周期元素:
以下元素均为短周期元素:
(1)D的最低价含氧酸的电子式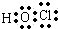 .
.
(2)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.
(3)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比1:1反应的离子方程式为CO32-+Cl2+H2O=ClO-+Cl-+HCO-3.
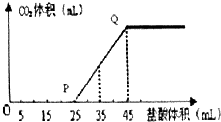
(4)A的最高价氧化物的水化物的溶液中通入一定量CO2得溶液X,X中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
①X溶液中溶质的化学式NaOH和Na2CO3.
②当加入35mL盐酸时,产生CO2的体积为224mL(标准状况).
 以下元素均为短周期元素:
以下元素均为短周期元素:| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第三周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
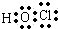 .
.(2)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.
(3)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比1:1反应的离子方程式为CO32-+Cl2+H2O=ClO-+Cl-+HCO-3.
(4)A的最高价氧化物的水化物的溶液中通入一定量CO2得溶液X,X中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
①X溶液中溶质的化学式NaOH和Na2CO3.
②当加入35mL盐酸时,产生CO2的体积为224mL(标准状况).
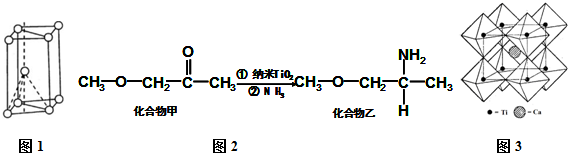
 ,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如下图1所示,为六方最密堆积(填堆积方式).
,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如下图1所示,为六方最密堆积(填堆积方式).