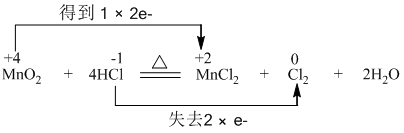
题目内容
4.阿魏酸在食品、医药等方面有若广泛用途.一种合成阿魏酸的反应可表示为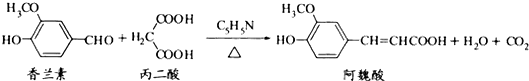
下列说法正确的是( )
| A. | 与香兰素互为同分异构体,分子中有5种不同化学环境的氢,且能发生银镜反应的酚类化合物有2种 | |
| B. | 香兰素、阿魏酸均可与NaHCO3、NaOH溶液反应 | |
| C. | 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 | |
| D. | 香兰素、阿魏酸均可与溴水反应,且反应类型完全相同 |
分析 A.其同分异构体为 和
和 ,含有两个羟基且两个羟基和-CH2CHO为于相邻或相间时有两种结构,含有一个甲酸甲酯基和一个酚羟基,且二者处于相对位置;
,含有两个羟基且两个羟基和-CH2CHO为于相邻或相间时有两种结构,含有一个甲酸甲酯基和一个酚羟基,且二者处于相对位置;
B.羧基能和碳酸氢钠反应;酚羟基、羧基和酯基能和NaOH溶液反应;
C.香兰素、阿魏酸都能发生取代、加成,但它们都不能进行消去反应;
D.香兰素能和浓溴水发生取代反应和氧化反应、阿魏酸能和浓溴水发生取代反应和加成反应.
解答 解:A.根据条件,其同分异构体为 和
和 ,含有两个羟基且两个羟基和-CH2CHO为于相邻或相间时有两种结构,含有一个甲酸甲酯基和一个酚羟基,且二者处于相对位置,所以一共有5种同分异构体,故A正确;
,含有两个羟基且两个羟基和-CH2CHO为于相邻或相间时有两种结构,含有一个甲酸甲酯基和一个酚羟基,且二者处于相对位置,所以一共有5种同分异构体,故A正确;
B.香兰素中含有酚羟基,阿魏酸中含有酚羟基和羧基,这两种官能团都可以与 Na2CO3、NaOH溶液反应,但香兰素不能和碳酸氢钠反应,故B错误;
C.香兰素、阿魏酸都能发生取代、加成,但它们都不能进行消去反应.故C错误;
D.香兰素能和浓溴水发生取代反应和氧化反应、阿魏酸能和浓溴水发生取代反应和加成反应,所以其反应类型不完全相同,故D错误;
故选A.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,注意香兰素中醛基能被溴氧化,为易错点.

练习册系列答案
相关题目
15. 以下元素均为短周期元素:
以下元素均为短周期元素:
(1)D的最低价含氧酸的电子式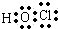 .
.
(2)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.
(3)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比1:1反应的离子方程式为CO32-+Cl2+H2O=ClO-+Cl-+HCO-3.
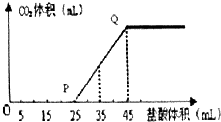
(4)A的最高价氧化物的水化物的溶液中通入一定量CO2得溶液X,X中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
①X溶液中溶质的化学式NaOH和Na2CO3.
②当加入35mL盐酸时,产生CO2的体积为224mL(标准状况).
 以下元素均为短周期元素:
以下元素均为短周期元素:| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第三周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
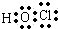 .
.(2)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.
(3)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比1:1反应的离子方程式为CO32-+Cl2+H2O=ClO-+Cl-+HCO-3.
(4)A的最高价氧化物的水化物的溶液中通入一定量CO2得溶液X,X中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
①X溶液中溶质的化学式NaOH和Na2CO3.
②当加入35mL盐酸时,产生CO2的体积为224mL(标准状况).
12.生物燃料电池是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化率高,是一种真正意义上的绿色电池,其工作原理如图所示.已知C1极的电极反应为C2H5OH+3H2O-12e-═2CO2+12H+.下列说法中不正确的是( )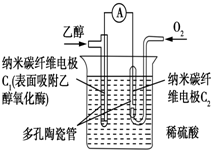

| A. | C1极为电池负极,C2极为电池正极 | |
| B. | 溶液中的H+向C1电极移动 | |
| C. | 该生物燃料电池的总反应方程式为C2H5OH+3O2═2CO2+3H2O | |
| D. | 电流由C2极经外电路流向C1极 |
13.下列四种固体物质中,既存在离子键又存在共价键的是( )
| A. | NH4Cl | B. | HCl | C. | MgCl2 | D. | CH4 |
14.用下列实验装置进行的实验,能达到相应的实验目的是( )
| A. |  设计铜锌原电池 | B. |  制备氢氧化亚铁并观察其颜色 | ||
| C. | 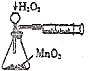 定量测定H2O2的分解速率 | D. | 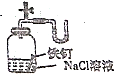 证明铁生锈与空气有关 |