题目内容
16.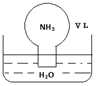 标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法错误的是( )
标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法错误的是( )| A. | 水最终会充满整个烧瓶 | |
| B. | 所得溶液的物质的量浓度为 $\frac{1}{22.4}$mol•L-1 | |
| C. | 所得溶液的质量分数为$\frac{17}{22400}$ρ | |
| D. | 将氨气换为二氧化氮,所得溶液的物质的量浓度也为$\frac{1}{22.4}$mol•L-1 |
分析 A.氨气溶于水,溶液体积等于氨气体积;
B.根据n=$\frac{V}{Vm}$计算氨气物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度;
C.根据c=$\frac{1000ρω}{M}$计算溶液的质量分数;
D.依据二氧化氮与水反应方程式:3NO2+H2O═2HNO3+NO,计算解答.
解答 解:A.氨气溶于水,水最终会充满整个烧瓶,故A正确;
B.氨气物质的量为$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,氨气溶于水,溶液体积等于氨气体积,溶液物质的量浓度为$\frac{\frac{V}{22.4}}{V}$=$\frac{1}{22.4}$mol•L-1,故B正确;
C.根据c=$\frac{1000ρω}{M}$可知,溶液的质量分数ω=$\frac{17×\frac{1}{22.4}}{1000ρ}$=$\frac{17}{22400ρ}$,故C错误;
D.将氨气换为二氧化氮,则二氧化氮物质的量为$\frac{V}{22.4}$mol,反应生成硝酸的物质量为$\frac{V}{22.4}$×$\frac{2}{3}$,反应生成NO物质量为:$\frac{V}{22.4}$×$\frac{1}{3}$,一氧化氮不溶于水,所以最后溶液体积为$\frac{2}{3}$V,则得到硝酸的物质的量浓度C=$\frac{\frac{V}{22.4}×\frac{2}{3}}{\frac{2}{3}×V}$=$\frac{1}{22.4}$mol/L,故D正确;
故选:C.
点评 本题考查溶液浓度有关计算,题目难度中等,涉及物质的量浓度、质量分数的计算,注意理解掌握物质的量浓度与质量分数之间关系,试题培养了学生的化学计算能力.

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| A. | 亚硫酸溶液 | B. | Na2S溶液 | C. | CuSO4溶液 | D. | FeSO4溶液 |
| A. |  | B. |  | C. |  | D. |  |

| A. | 分子式为C16H18O9 | |
| B. | 0.1mol绿原酸最多与0.8 molNaOH反应 | |
| C. | 能发生取代反应和消去反应 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
| A. | 制备氯气时严格检查装置的气密性,并设置尾气吸收装置 | |
| B. | 稀释浓硫酸时,将水倒入浓硫酸中,使用玻璃棒不断搅拌 | |
| C. | 在敞口容器中进行铜与浓硝酸的反应,并观察生成的气体 | |
| D. | 向一支试管中加入少量水,向其中投入一块黄豆大小的钠 |
| A. | 升高温度可以提高NO和CO的转化率 | |
| B. | 使用高效催化剂可以提高NO和CO的转化率 | |
| C. | 反应达到平衡后,NO 的生成速率和消耗速率相等 | |
| D. | 若该反应已达到平衡状态,增大压强(通过减小体积实现)对平衡无影响 |

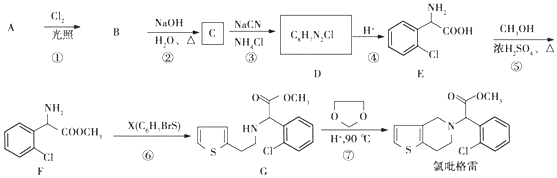
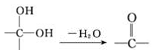 ;②
;②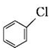 中氯原子较难水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$
中氯原子较难水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$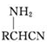
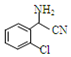 ;C分子中最多有14个原子共平面.
;C分子中最多有14个原子共平面.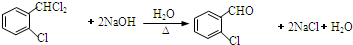 .
. ,需要经历的反应类型有②①③④③(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有②①③④③(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物 的最后一步反应HOCH2CH2OH+HCHO$\stackrel{酸}{→}$
的最后一步反应HOCH2CH2OH+HCHO$\stackrel{酸}{→}$ .
.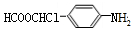 .
.