题目内容
6.造成西安雾霾的重要原因之一是汽车尾气,已知汽车尾气无害化处理的反应之一为 2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0,下列说法正确的是( )| A. | 升高温度可以提高NO和CO的转化率 | |
| B. | 使用高效催化剂可以提高NO和CO的转化率 | |
| C. | 反应达到平衡后,NO 的生成速率和消耗速率相等 | |
| D. | 若该反应已达到平衡状态,增大压强(通过减小体积实现)对平衡无影响 |
分析 A.该反应为放热反应,升高温度,平衡逆向移动;
B.催化剂对平衡移动无影响;
C.平衡时同种物质的正逆反应速率相等;
D.该反应为气体体积减小的反应.
解答 解:A.该反应为放热反应,升高温度,平衡逆向移动,则转化率减小,故A错误;
B.催化剂对平衡移动无影响,则使用高效催化剂,NO和CO的转化率不变,故B错误;
C.平衡时同种物质的正逆反应速率相等,则反应达到平衡后,NO 的生成速率和消耗速率相等,故C正确;
D.该反应为气体体积减小的反应,则增大压强,平衡正向移动,故D错误;
故选C.
点评 本题考查化学平衡移动,为高频考点,把握温度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意反应的特点,题目难度不大.

练习册系列答案
相关题目
16.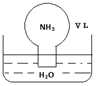 标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法错误的是( )
标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法错误的是( )
 标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法错误的是( )
标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法错误的是( )| A. | 水最终会充满整个烧瓶 | |
| B. | 所得溶液的物质的量浓度为 $\frac{1}{22.4}$mol•L-1 | |
| C. | 所得溶液的质量分数为$\frac{17}{22400}$ρ | |
| D. | 将氨气换为二氧化氮,所得溶液的物质的量浓度也为$\frac{1}{22.4}$mol•L-1 |
17.下列微粒中,既有氧化性,又有还原性的是( )
| A. | Mg | B. | SO2 | C. | Zn2+ | D. | Cl- |
14.在下列溶液中,能大量从存的离子组是( )
| A. | 常温下pH=13的溶液中能大量存在:Na+、Al3+、Cl-、SO42- | |
| B. | 与金属铝反应有大量气泡产生的无色溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:SCN-、I-、Na+、Cl- | |
| D. | 溶液通入足量氨气后各离子还能大量存在:K+、Na+、SO42-、CO32- |
1.在实验室进行下列实验,括号内的实验仪器或试剂都能用得上的是( )
| A. | 配制100g20%的氢氧化钠溶液(烧杯、100mL容量瓶、胶头滴管) | |
| B. | 钠的焰色反应(铂丝、硫酸钠溶液、稀盐酸) | |
| C. | 从碘水中提取碘(蒸发皿、酒精灯、玻璃棒) | |
| D. | 除去自来水中的Cl-(铁架台、玻璃棒、漏斗) |
11.不能正确表示下列反应的离子方程式是( )
| A. | Na与稀硫酸反应的离子方程式为2Na+2H+═2 Na++H2↑ | |
| B. | Na2O2溶于水产生O2:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀 Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 饱和碳酸钠溶液中通入过量二氧化碳气体,溶液变浑浊CO32-+CO2+H2O=HCO3- |
15.(1)2017年1月2日安徽六安出现了严重雾霾情况,经分析该雾霾中含有大量PM2.5、PM10、汽车尾气等等.将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5试样的pH=4.
(2)在一定条件下的溶液中,反应FeCl3+3KSCN?Fe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,加入少量KCl固体,能使平衡不移动(填“正向”、“逆向”、“不”)
(3)泡沫灭火器是硫酸铝和碳酸氢钠溶液反应,反应的离子方程式是Al3++3HCO3-=Al(OH)3↓+CO2↑.
(4)常温下,一定体积PH=2的二元弱酸H2R溶液与等体积PH=12的NaOH溶液混合,该混合溶液中电荷守恒的关系式是c(Na+)+c(H+)=c(HR-)+2c(R2-)+c(OH-).
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)在一定条件下的溶液中,反应FeCl3+3KSCN?Fe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,加入少量KCl固体,能使平衡不移动(填“正向”、“逆向”、“不”)
(3)泡沫灭火器是硫酸铝和碳酸氢钠溶液反应,反应的离子方程式是Al3++3HCO3-=Al(OH)3↓+CO2↑.
(4)常温下,一定体积PH=2的二元弱酸H2R溶液与等体积PH=12的NaOH溶液混合,该混合溶液中电荷守恒的关系式是c(Na+)+c(H+)=c(HR-)+2c(R2-)+c(OH-).
16.某氢氧化钠溶液的实际浓度为0.1000mol/L.A同学的实验测定值为0.095mol/L,则他测定的相对误差为( )
| A. | 5.26% | B. | -5.26% | C. | 5% | D. | -5% |



