题目内容
用单线桥表示下列方程式;
MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
MnO2+4HCl(浓)
| ||
考点:氧化还原反应
专题:
分析:该反应中Mn元素化合价由+4价变为+2价、部分Cl元素化合价由-1价变为0价,所以Mn元素得电子、部分Cl元素失电子,转移电子总数为2,据此分析解答.
解答:
解:该反应中Mn元素化合价由+4价变为+2价、部分Cl元素化合价由-1价变为0价,所以Mn元素得电子、部分Cl元素失电子,转移电子总数为2,电子从Cl元素转移到Mn元素,单线桥表示该反应方程式为: (浓)═MnCl2+Cl2↑+2H2O,
(浓)═MnCl2+Cl2↑+2H2O,
答:单线桥表示该方程式为: (浓)═MnCl2+Cl2↑+2H2O.
(浓)═MnCl2+Cl2↑+2H2O.
 (浓)═MnCl2+Cl2↑+2H2O,
(浓)═MnCl2+Cl2↑+2H2O,答:单线桥表示该方程式为:
 (浓)═MnCl2+Cl2↑+2H2O.
(浓)═MnCl2+Cl2↑+2H2O.
点评:本题考查氧化还原反应中电子转移方向和数目的表示方法,知道元素化合价变化是解本题关键,知道箭头的含义,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
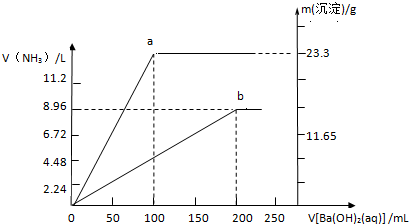
将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 2.8L(标准状况),原混合物的质量一定不可能是( )
| A、5g | B、4g | C、8g | D、10g |
一定温度下,在一个容积可变的密闭容器中,发生C(s)+H2O(g)?CO(g)+H2(g)反应,下列能判断该反应达到化学平衡状态的是( )
| A、容器中的压强不变 |
| B、2 mol H-O键断裂的同时1 mol H-H键形成 |
| C、c(CO)=c(H2) |
| D、密闭容器的容积不再改变 |
将铁铝矾[Al2Fe(SO4)4?xH2O]溶于水中,得到浅绿色溶液,下列有关该溶液的叙述正确的是( )
| A、铁铝矾有净水作用,其水溶液显中性 |
| B、向该溶液中加入Na2S溶液,有淡黄色沉淀 |
| C、在空气中,蒸干并灼烧该溶液,最后所得的残留固体为Al2O3、Fe2O3 |
| D、用惰性电极电解该溶液时,阴极区有沉淀 |
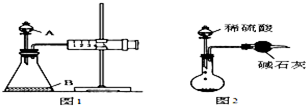 学校实验室现有含少量NaCl杂质的Na2CO3固体样品,某化学兴趣小组的同学决定测定样品Na2CO3的质量分数,甲、乙两位同学分别设计出下列两种实验方案:
学校实验室现有含少量NaCl杂质的Na2CO3固体样品,某化学兴趣小组的同学决定测定样品Na2CO3的质量分数,甲、乙两位同学分别设计出下列两种实验方案: