题目内容
现有(NH4)SO4和NH4NO3的混合溶液,向该混合溶液中加入Ba( OH)2溶液,并加热使之充分反应,直至Ba( OH)2溶液过量.加入Ba( OH)2溶液的体积与产生沉淀的质量和放出NH3的体积(标准状况下)的关系如图,曲线a代表沉淀的质量变化,曲线b代表NH3的体积变化(假设NH3全部放出).
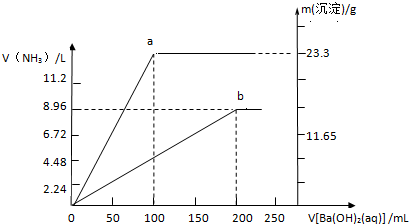
(1)混合溶液中NH4+的物质的量为 mol.
(2)混合溶液中NO3-的物质的量为 mol.
(3)当加入Ba( OH)2溶液的体积在100-200mL范围内,发生反应的离子方程式为 .

(1)混合溶液中NH4+的物质的量为
(2)混合溶液中NO3-的物质的量为
(3)当加入Ba( OH)2溶液的体积在100-200mL范围内,发生反应的离子方程式为
考点:离子方程式的有关计算
专题:计算题
分析:(1)Ba( OH)2与NH4NO3和(NH4)2SO4的混合物生成氨气,反应中NH4+和OH-生成NH3和H2O,根据氨气的物质的量求出铵根离子的物质的量;
(2)钡离子与硫酸根离子结合生成沉淀,根据沉淀的物质的量求出硫酸根离子的物质的量,再结合铵根离子的物质的量求出NO3-的物质的量;
(3)根据图象分析,当加入Ba( OH)2溶液的体积在100-200mL,反应生成氨气和硫酸钡沉淀.
(2)钡离子与硫酸根离子结合生成沉淀,根据沉淀的物质的量求出硫酸根离子的物质的量,再结合铵根离子的物质的量求出NO3-的物质的量;
(3)根据图象分析,当加入Ba( OH)2溶液的体积在100-200mL,反应生成氨气和硫酸钡沉淀.
解答:
解:(1)Ba( OH)2与NH4NO3和(NH4)2SO4的混合物生成氨气,发生反应NH4++OH-
NH3↑+H2O,由图象可知生成的氨气的最大值为8.96L,则n(NH3)=
=
=0.4mol,则铵根离子的物质的量为0.4mol;
故答案为:0.4;
(2)已知铵根离子的物质的量为0.4mol,硫酸钡为23.3g,n(BaSO4)=
=0.1mol,则n(SO42-)=0.1mol,
所以(NH4)SO4为0.1mol,则n(NH4NO3)=0.4mol-0.1mol×2=0.2mol,则NO3-的物质的量为0.2mol;
故答案为:0.2;
(3)根据图象分析,当加入Ba( OH)2溶液的体积在100-200mL,反应生成氨气和硫酸钡沉淀,则反应的离子方程式为:SO42-+Ba2++2NH4++2OH-
2NH3↑+BaSO4↓+2H2O;
故答案为:SO42-+Ba2++2NH4++2OH-
2NH3↑+BaSO4↓+2H2O.
| ||
| V |
| Vm |
| 8.96L |
| 22.4L/mol |
故答案为:0.4;
(2)已知铵根离子的物质的量为0.4mol,硫酸钡为23.3g,n(BaSO4)=
| 23.3g |
| 233g/mol |
所以(NH4)SO4为0.1mol,则n(NH4NO3)=0.4mol-0.1mol×2=0.2mol,则NO3-的物质的量为0.2mol;
故答案为:0.2;
(3)根据图象分析,当加入Ba( OH)2溶液的体积在100-200mL,反应生成氨气和硫酸钡沉淀,则反应的离子方程式为:SO42-+Ba2++2NH4++2OH-
| ||
故答案为:SO42-+Ba2++2NH4++2OH-
| ||
点评:本题以图象形式,考查混合物的有关计算,注意发生反应的本质,利用离子方程式进行解答,综合考查学生分析解决问题的能力,难度中等.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
18g某混合气体通过足量的Na2O2固体充分反应后固体增重2g,则该混合气体不可能是( )
| A、H2O、O2 |
| B、CO2、H2 |
| C、CO2、H2O、O2 |
| D、CO2、CO |
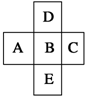 在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )
在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )| A、B、D的原子序数之差可能为2 |
| B、E、B的原子序数之差可能是8、18或32 |
| C、5种元素的核电荷总数之和可能为5a+10 |
| D、A、E的原子序数之差可能是7 |
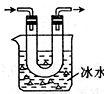
 甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.