题目内容
铜金合金用途广泛,而且Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.金稳定性强,常作为首饰.请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为 ;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是 ;SO42-中S原子的杂化轨道类型是 ;
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为 ;一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为 ;该晶体中,原子之间的作用力是 ;若该晶体的晶胞边长为a nm,则合金的密度为 g/cm3(NA约为6.02×1023,请写出计算过程)
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为 .
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为
考点:铜金属及其重要化合物的主要性质,原子核外电子排布,晶胞的计算
专题:
分析:(1)加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水;
(2)无水硫酸铜是白色的,CuSO4?5H2O是蓝色的,显示水合铜离子特征蓝色;根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型和杂化方式;
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,以此判断电子排布式;利用均摊法计算晶胞中含有的原子个数来确定原子个数之比,金属晶体中存在金属键;该晶体的化学式为Cu3Au,根据化学式求算晶胞的质量,根据该晶体的晶胞边长为anm求算该晶体的晶胞体积,依此计算出晶体的密度;
(4)根据氟化钙的结构确定该晶体储氢后的化学式.
(2)无水硫酸铜是白色的,CuSO4?5H2O是蓝色的,显示水合铜离子特征蓝色;根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型和杂化方式;
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,以此判断电子排布式;利用均摊法计算晶胞中含有的原子个数来确定原子个数之比,金属晶体中存在金属键;该晶体的化学式为Cu3Au,根据化学式求算晶胞的质量,根据该晶体的晶胞边长为anm求算该晶体的晶胞体积,依此计算出晶体的密度;
(4)根据氟化钙的结构确定该晶体储氢后的化学式.
解答:
解:(1)加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为:Cu+2 H2SO4(浓)
CuSO4+SO2↑+2H2O;
故答案为:Cu+2 H2SO4(浓)
CuSO4+SO2↑+2H2O;
(2)白色无水硫酸铜可与水结合生成蓝色的CuSO4?5H2O,显示水合铜离子特征蓝色;
SO42-离子中含有4个σ键,没有孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
故答案为:白色无水硫酸铜可与水结合生成蓝色的CuSO4?5H2O,显示水合铜离子特征蓝色;sp3;
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则最外层电子排布式为6s1,在晶胞中Cu原子处于面心,N(Cu)=6×
=3,Au原子处于顶点位置,N(Au)=8×
=1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键;该晶体的化学式为Cu3Au,晶胞质量=
=
g,该晶体的晶胞边长为anm,则该晶体的晶胞体积=a3×10-21cm3,则该晶体的密度为
=
g/cm3,
故答案为:6s1;3:1;金属键;
;
(4)CaF2的结构如图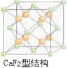 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
故答案为:Cu3AuH8.
| ||
故答案为:Cu+2 H2SO4(浓)
| ||
(2)白色无水硫酸铜可与水结合生成蓝色的CuSO4?5H2O,显示水合铜离子特征蓝色;
SO42-离子中含有4个σ键,没有孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
故答案为:白色无水硫酸铜可与水结合生成蓝色的CuSO4?5H2O,显示水合铜离子特征蓝色;sp3;
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则最外层电子排布式为6s1,在晶胞中Cu原子处于面心,N(Cu)=6×
| 1 |
| 2 |
| 1 |
| 8 |
| 3×64+197 |
| 6.02×1023 |
| 389 |
| 6.02×1023 |
| ||
| a3×10-21 |
| 0.65 |
| a3 |
故答案为:6s1;3:1;金属键;
| 0.65 |
| a3 |
(4)CaF2的结构如图
 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,故答案为:Cu3AuH8.
点评:本题考查硫酸铜制备的方程式、水的检验方法、杂化轨道理论和立体构型、元素周期律的应用、元素的核外电子排布式等知识,难度较大.答题时注意根据信息得出合理推论.

练习册系列答案
相关题目
已知2A(g)+B(g)?2C(g)+D(s),△H=-QkJ?mol-1,一定条件下,将2mol A和1mol B放入一体积可变的密闭容器中,测得容器体积为200L,一段时间达平衡后,测得体积变为140L,下列说法不正确的是( )
| A、平衡时A的转化率为90% |
| B、若要使达到平衡时的各气体的物质的量与题目的平衡相同,可充入2mol C和2mol D |
| C、在相同条件下,按2:1充入A和B,平衡时容器体积为210L,则充入A的物质的量为3mol |
| D、相同条件下,若充入4mol C和2mol D,达平衡时放出能量1.8QkJ |
X、Y、Z、W为四种短周期主族元素.其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )
| A、Y元素最高价氧化物对应水化物的化学式为HYO4 |
| B、原子半径由小到大的顺序为:W>X>Z |
| C、Z元素可以形成两种酸性氧化物 |
| D、Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定 |
 甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.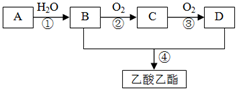 已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.回答下列问题:
已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.回答下列问题: