题目内容
7.下列说法中正确的是( )| A. | 氢元素有三种同位素,则氢气分子有三种 | |
| B. | 稀有气体元素原子最外层都达到8电子稳定结构 | |
| C. | 第IA、ⅡA族元素的阳离子与同周期稀有气体元素原子具有相同的核外电子排布 | |
| D. | 将盛有NH4HCO3粉末的小烧杯放人盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固,该反应中,热能转化为产物内部的能量 |
分析 A.氢的同位素为H、D、T,1个氢气分子由2个原子构成;
B.He的最外层电子为2;
C.第IA、ⅡA族元素的阳离子的电子层比原子电子层少1,同周期稀有气体元素原子与同周期第IA、ⅡA族元素的原子具有相同电子层;
D.醋酸逐渐凝固,温度降低,则反应为吸热反应.
解答 解:A.氢的同位素为H、D、T,1个氢气分子由2个原子构成,可形成H2、D2、T2、HD、HT、DT共6种分子,故A错误;
B.He的最外层电子为2,其它稀有气体原子最外层都达到8电子稳定结构,故B错误;
C.第IA、ⅡA族元素的阳离子的电子层比原子电子层少1,同周期稀有气体元素原子与同周期第IA、ⅡA族元素的原子具有相同电子层,则第IA、ⅡA族元素的阳离子与同周期稀有气体元素原子的核外电子排布不同,故C错误;
D.醋酸逐渐凝固,温度降低,则反应为吸热反应,可知该反应中热能转化为产物内部的能量,故D正确;
故选D.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握分子构成、原子结构、化学反应中能量变化为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
17.下列有关实验原理或操作正确的是( )

| A. | 用湿润的pH试纸测定溶液的pH | |
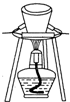
| B. | 用如图所示装置灼烧碱式碳酸铜[Cu2(OH)2CO3]制取氧化铜 | |
| C. | 用铜丝蘸取草木灰在酒精灯火焰灼烧检验钾元素 | |
| D. | 称取0.4g NaOH,放入100mL容量瓶中,加入蒸馏水溶解,用胶头滴管定容至刻度线,振荡摇匀,配制100mL 0.10mol/L NaOH溶液 |
15.下列叙述正确的是( )
| A. | H2O的摩尔质量为18g | |
| B. | 3.01×1023个SO2分子的质量为32g | |
| C. | 标准状况下,1 mol任何物质体积均为22.4L | |
| D. | 将0.1mol NH3溶于1L水,配成溶液中溶质的物质的量浓度为0.1mol/L |
2.制取氯乙烷最好的方法是( )
| A. | 乙烷和氯气反应 | B. | 乙烯和氯气反应 | ||
| C. | 乙烯和氯化氢反应 | D. | 乙烯和氢气、氯气反应 |
12.欲除去Cl2中的少量HCl气体,可选用( )
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | 饱和食盐水 | D. | 石灰水 |
19.下列混合物可用加热法分离的是( )
| A. | 碘、氯化铵 | B. | 氯化铵、硫酸钡 | C. | 硫化钠、氯酸钾 | D. | 氯化钠、硫酸钠 |
14.下列各组物质在一定条件下,可制得较纯净的1,2-二氯乙烷的是( )
| A. | 乙烷与氯气混合 | B. | 乙烯与氯化氢混合 | ||
| C. | 乙烯与氯气混合 | D. | 乙炔与氯气混合 |
15.下列有机物的命名正确的是( )
| A. | 3,4,4-三甲基己烷 | B. | 2-甲基-4-乙基-1-戊烯 | ||
| C. | 2-乙基-1-戊烯 | D. | 2-乙基丁烷 |