��Ŀ����
19�����ǵؿ��к�����ߵĽ���Ԫ�أ��䵥�ʼ��������������������й㷺��Ӧ�ã���1����ͨˮ�����Ҫ�ɷ�֮һ���������ƣ�3CaO•Al2O3����3CaO•Al2O3��Al�Ļ��ϼ�Ϊ+3��
��2���Ȼ����㷺�����л��ϳɺ�ʯ��ҵ�Ĵ�������������ۣ�Al2O3����̿�ۻ�Ϻ���Ȳ�ͨ���������ɵõ��Ȼ�����ͬʱ����CO��д���÷�Ӧ�Ļ�ѧ����ʽAl2O3+3C+3Cl2$\frac{\underline{\;��\;}}{\;}$2AlCl3+3CO��
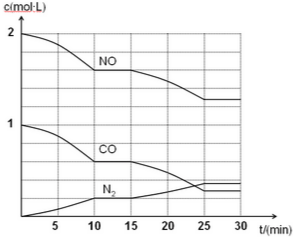
��3���ֽ�һ���������ۺ�þ�۵Ļ������100mLϡ�����ַ�Ӧ����Ӧ���������κ�����ų����ڷ�Ӧ���������Һ�У�����4mol•L-1��NaOH��Һ������NaOH��Һ�������mL������������������Ĺ�ϵ��ͼ��ʾ��
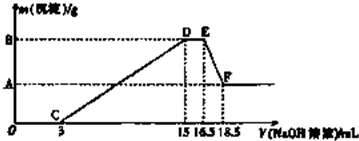
��D��E�����з�Ӧ�����ӷ���ʽΪNH4++OH-=NH3��+H2O��
��A���Ӧ���������ֵ��0.696g��ԭϡ�����Ũ����0.66mol•L-1��
���� ��1�����������������ƵĻ�ѧʽCa3Al2O6�����û������и�Ԫ�صĻ��ϼ۴�����Ϊ0��ԭ���ɻ������иơ���Ϊ+2��-2�ۣ����㻯������AlԪ�صĻ��ϼۣ�
��2�����ݷ�Ӧ�������ͷ�Ӧ����д����Ӧ����ʽ��
��3���ȼ���NaOH��Һʱû�г������ɣ�˵��NaOH�Ⱥ���Һ���ᷴӦ����������ʣ�࣬������ӦHNO3+NaOH=NaNO3+H2O��
������ʣ�࣬����þ������ȫ�ܽ⣬��Һ�д���Al3+��Mg2+�������μ�NaOH��Һ�г������ɣ�������ӦAl3++3OH-=Al��OH��3����Mg2++2OH-=Mg��OH��2������������NaOH�ļ��룬���������ʵ��������ӣ���D��ʱAl3+��Mg2+ǡ����ȫ������
�����μ�NaOH�����������ʵ������䣬˵��������Ӧ NH4++OH-=NH3��+H2O����E��ʱ����Һ�е�����ֻ��NaNO3��
�����μ�NaOH��Һ�����������ʵ�����С��������Ӧ Al��OH��3+OH-=AlO2-+2H2O���ݴ˷������
��� �⣺��1���軯����Ca3Al2O6��AlԪ�ػ��ϼ�Ϊn�ۣ����������и�Ԫ�ػ��ϼ۴�����Ϊ���ԭ���У�+2����3+n��2+��-2����6=0����֮��n=+3��
�ʴ�Ϊ��+3��
��2�����������£���������������̼��Ӧ�����Ȼ�����һ����̼����Ӧ����ʽΪ��Al2O3+3C+3Cl2$\frac{\underline{\;��\;}}{\;}$2AlCl3+3CO��
�ʴ�Ϊ��Al2O3+3C+3Cl2$\frac{\underline{\;��\;}}{\;}$2AlCl3+3CO��
��3���ȼ���NaOH��Һʱû�г������ɣ�˵��NaOH�Ⱥ���Һ���ᷴӦ����������ʣ�࣬������ӦHNO3+NaOH=NaNO3+H2O��
������ʣ�࣬����þ������ȫ�ܽ⣬��Һ�д���Al3+��Mg2+�������μ�NaOH��Һ�г������ɣ�������ӦAl3++3OH-=Al��OH��3����Mg2++2OH-=Mg��OH��2������������NaOH�ļ��룬���������ʵ��������ӣ���D��ʱAl3+��Mg2+ǡ����ȫ������
�����μ�NaOH�����������ʵ������䣬˵��������Ӧ NH4++OH-=NH3��+H2O����E��ʱ����Һ�е�����ֻ��NaNO3��
�����μ�NaOH��Һ�����������ʵ�����С��������Ӧ Al��OH��3+OH-=AlO2-+2H2O��
��D��E�������Ǽ����NaOH��NH4+��Ӧ�����ӷ���ʽΪ��NH4++OH-=NH3��+H2O���ʴ�Ϊ��NH4++OH-=NH3��+H2O��
���������þΪxmol����Ϊymol������Al3+��Mg2+��ȫ���������ĵ�NaOH�����Ϊ12mL�����У�2x+3y=12mL��10-3��4mol/L����
�����ɵ�����������ȫ�ܽ�����2mLNaOH��Һ�����У�y=2mL��10-3��4mol/L����
���x=0.012mol y=0.008mol
��A��ʱ������ֻ��Mg��OH��2���ʳ���������m=0.012mol��58g/mol=0.696g��
E��ʱ����Һ�е�����ֻ��NaNO3������E��ʱ�������n��NaOH��=n��HNO3��=16.5mL��10-3��4mol/L=0.066mol
��ԭ��Һ����������ʵ���Ϊ0.066mol�����ʵ���c=$\frac{n}{V}$=$\frac{0.066mol}{0.1L}$=0.66mol��
�ʴ�Ϊ��0.696g��0.66��
���� ���⿼��������ԭ��Ӧ�����ӷ���ʽ�ļ��㣬��ȷͼƬ�и����η����ķ�Ӧ�ǽⱾ��ؼ���֪�������յ���Һ�ж�Ӧ�����ʣ��ٽ�Ϸ���ʽ��ԭ���غ���н���ۺ��Խ�ǿ��

 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д� ���������ܾ��е������ǣ�������
���������ܾ��е������ǣ�������| A�� | ����ʹ��ˮ��ɫ��Ҳ��ʹ����KMnO4��Һ��ɫ | |
| B�� | ������ˮ���л��ܼ� | |
| C�� | ����H2��һ�������·�����Ӧ | |
| D�� | �ܷ����Ӿ۷�Ӧ�����������  ��ʾ ��ʾ |
| A�� | ���������� | B�� | ���л�ԭ�� | C�� | ����Ư���� | D�� | ���м��Լ� |
| A�� | ���ǷǼ��Է��� | B�� | ����ԭ�Ӷ���ȡsp�ӻ� | ||
| C�� | Sԭ�Ӻ�Cԭ�Ӷ�û�й¶Ե��� | D�� | SO2ΪV�νṹ��CO2Ϊֱ���νṹ |
 ����ļ���������μ�������Һ����������Ӧ������������������������������ҵ�������ϵ��������ͼ��ʾ���ǣ�������
����ļ���������μ�������Һ����������Ӧ������������������������������ҵ�������ϵ��������ͼ��ʾ���ǣ�������| ��� | �� | �� |
| A | þ�� | ϡ���� |
| B | ��������Һ | ����������Һ |
| C | ���ᱵ��Һ | ��������Һ |
| D | ��������� | ϡ���� |
| A�� | A | B�� | B | C�� | C | D�� | D |

 ��
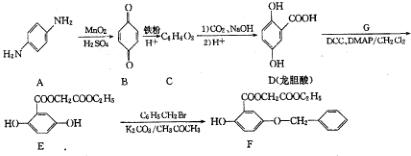
��
 ��
�� ��
��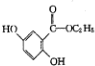 ����һ��ͬ���칹��Ľṹ��ʽ
����һ��ͬ���칹��Ľṹ��ʽ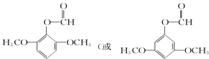 ��
��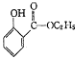 ���ĺϳ�·������ͼ�����Լ����ã��������Ϣ��
���ĺϳ�·������ͼ�����Լ����ã��������Ϣ�� ��
��