题目内容
6.已知热化学方程式:2SO2(g)+O2(g)?2SO3(g)+196kJ,下列说法中正确的是( )| A. | 在容器中充入2mol SO2(g)和2mol O2(g)充分反应,最终放出的热量为196kJ | |
| B. | 如果2molSO3(g)完全分解成SO2(g)和O2(g)时需要吸收196kJ的热量,若加入适当的催化剂后,分解所需要的热量会小于196kJ | |
| C. | 在接触法制硫酸中,通常不采用低温或者很大压强的方式来提高三氧化硫的产率 | |
| D. | 工业生产中,在吸收塔内用水吸收SO3,促进平衡的正向移动,提高了原料利用率 |
分析 A、反应是可逆反应不能进行彻底;
B、热化学方程式的焓变是指对应化学方程式量全部完全反应放出的热量,与催化剂无关;
C、低温反应速率慢,高压对设备要求高,成本高,而实际的转化率变化很小;
D、工业生产中,在吸收塔内用98.3%的浓硫酸吸收SO3.
解答 解:A、反应是可逆反应不能进行彻底,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量小于196.6kJ,故A错误;
B、催化剂只能改变反应所需的活化能,不能改变焓变,故B错误;
C、在接触法制硫酸中,通常不采用低温或者很大压强的方式来提高三氧化硫的产率,因为低温反应速率慢,高压对设备要求高,成本高,而实际的转化率变化很小,故C正确;
D、工业生产中,在吸收塔内用98.3%的浓硫酸吸收SO3.不能直接用水吸收,因为容易形成酸雾且吸收效率低,故D错误.
故选:C.
点评 本题考查了热化学方程式和焓变的关系分析、化学平衡移动与实际生产生活的联系,理解应用是解题关键,题目难度中等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
9.下列物质中既含有非极性键,又含有极性键的是( )
| A. | CO2 | B. | C2H6 | C. | NaOH | D. | H2O |
1.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g•L-1;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 常见气态氢化物的稳定性:X<Y<Z | |
| C. | 1molWM溶于足量水中完全反应,共转移2mol电子 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
18.X、Y、Z、T是四种原子序数递增的短周期元素,X形成的简单阳离子核外无电子,Y的最高价氧化物对应的水化物是强酸,Z是人体内含量最多的元素,T在同周期元素形成的简单阳离子中半径最小,则以下说法正确的是( )
| A. | 元素最高化合价的顺序为Z>Y>T>X | |
| B. | Y、Z分别形成的简单氢化物的稳定性为Z>Y | |
| C. | 由X、Y和Z三种元素构成的强电解质,对水的电离均起抑制作用 | |
| D. | 常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液不能反应 |
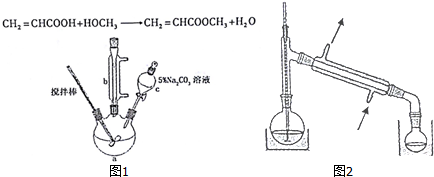
15.丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如图1所示:
①10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热.
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性.
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分.
可能用到的信息:
(注闪点低于500C属于极易燃烧物质)回答下列问题:
(1)仪器c的名称是分液漏斗.
(2)混合液用5%0Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度).
(3)请写出配制100g 5% Na2CO3溶液所使用的玻璃仪器烧杯、玻璃棒、量筒.
(4)关于产品的蒸馏操作(夹持装置未画出),图2中有2处错误,请分别写出温度计水银球位置、尾接管与锥形瓶接口密封.
为检验产率,设计如下实验:
①%2油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10.00mL,加热使之完全水解.
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCI溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL.
(5)计算本次酯化反应丙烯酸的转化率54.0%.
(6)请列举2条本实验中需要采取的安全防护措施通风橱中实验.防止明火.
①10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热.
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性.
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分.
可能用到的信息:
| 沸点 | 溶解性 | 着火点(闪点) | 毒性 | |
| 丙烯酸 | 142℃ | 与水互溶,易溶于有机溶剂 | 54℃ | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 11℃ | 有毒 |
| 丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 不详 | 无毒 |
(1)仪器c的名称是分液漏斗.
(2)混合液用5%0Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度).

(3)请写出配制100g 5% Na2CO3溶液所使用的玻璃仪器烧杯、玻璃棒、量筒.
(4)关于产品的蒸馏操作(夹持装置未画出),图2中有2处错误,请分别写出温度计水银球位置、尾接管与锥形瓶接口密封.
为检验产率,设计如下实验:
①%2油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10.00mL,加热使之完全水解.
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCI溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL.
(5)计算本次酯化反应丙烯酸的转化率54.0%.
(6)请列举2条本实验中需要采取的安全防护措施通风橱中实验.防止明火.
16.X、Y、Z、W为原子序数依次增大的短周期主族元素,X原子M层有1个电子,Y原子最外层电子数为最内层电子数的2倍,Z元素的最高化合价为最低化合价绝对值的3倍.下列叙述正确的是( )
| A. | 原子半径Z>X>Y | |
| B. | 最高价氧化物的水化物酸性强弱W>Z>Y | |
| C. | 简单气态氢化物的稳定性Z>W | |
| D. | W分别与X、Y形成的化合物化学键类型相同 |

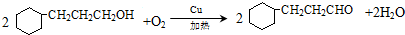 .
.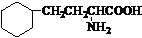 .写出满足下列条件的苯丙氨酸同分异构体的结构简式
.写出满足下列条件的苯丙氨酸同分异构体的结构简式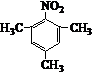 、
、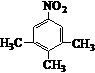 .
.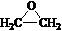 )制备1,4-戊二烯的合成路线(无机试剂任选).
)制备1,4-戊二烯的合成路线(无机试剂任选).