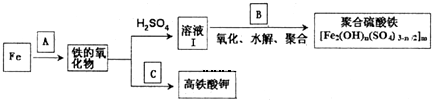
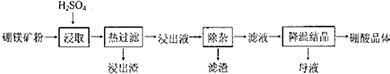
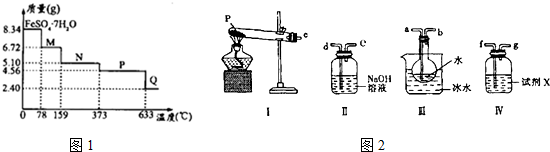
题目内容
12.向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1mol Ag.下列结论错误的是( )| A. | 溶液中Cu2+与Fe2+的物质的量比为1:2 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 氧化性:Zn2+>Cu2+>Fe3+>Ag+ | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
分析 加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1mol Ag,可知铁离子、银离子均被还原,氧化性Fe3+、Ag+大于Cu2+、Zn2+,以此来解答.
解答 解:A、Fe先还原Ag+,所以Fe2+:Cu2+=(0.1+0.1):0.1=2:1,故A正确;
B.根据金属铜和三价铁反应生成氯化铜和氯化亚铁,可知氧化性Cu2+<Fe3+,故B正确;
C.根据金属活动顺序表可知氧化性:Zn2+<Cu2+<Ag+,故C错误;
D.由电子守恒可知,1mol Fe恰好还原2mol Fe3+,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念的理解及应用,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
5.下列物质中属于盐的是( )
| A. | MgO | B. | H2SO4 | C. | NaOH | D. | KNO3 |
7.一氯代烃A(C5H11Cl)经水解后再氧化可得到有机物B,A的一种同系物(C4H9Cl)经水解得到有机物C,B 和C可发生酯化反应生成酯D,则D可能的结构有( )种.
| A. | 12 | B. | 16 | C. | 24 | D. | 32 |
4.下列不能用勒沙特列原理解释的是( )
①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②棕红色NO2加压后颜色先变深后变浅
③SO2催化氧化成SO3的反应,往往需要使用催化剂
④H2、I2、HI平衡混和气加压后颜色变深
⑤光照氯水,颜色变浅
⑥向盛有NO2的集气瓶中投入活性炭,颜色变浅
⑦加热氯化铁溶液,溶液变红.
①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②棕红色NO2加压后颜色先变深后变浅
③SO2催化氧化成SO3的反应,往往需要使用催化剂
④H2、I2、HI平衡混和气加压后颜色变深
⑤光照氯水,颜色变浅
⑥向盛有NO2的集气瓶中投入活性炭,颜色变浅
⑦加热氯化铁溶液,溶液变红.
| A. | ②③④ | B. | ①②⑥ | C. | ④⑤⑦ | D. | ③④⑥ |
1.有A、B、C、D、E、F、G七瓶不同物质的溶液,它们各是K2CO3、Na2SO4、NaCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种.为了鉴别,各取少量溶液进行两两混合,实验结果如表所示.表中“↓”表示生成沉淀或微溶化合物,“-”表示观察不到明显变化.试回答下面问题:
(1)A的化学式是NaCl?,D的化学式是?K2CO3,F的化学式是?Ba(OH)2,判断A理由是相互混合时A只与G反应生成沉淀,生成的沉淀为AgCl.
(2)写出B和E反应的离子反应方程式?Ca2++SO42-=CaSO4↓.
| A | B | C | D | E | F | G | |
| A | - | - | - | - | - | - | ↓ |
| B | - | - | - | - | ↓ | ↓ | ↓ |
| C | - | - | - | ↓ | ↓ | ↓ | |
| D | - | ↓ | - | ↓ | ↓ | ↓ | |
| E | - | ↓ | - | ↓ | - | ↓ | - |
| F | - | ↓ | ↓ | ↓ | ↓ | - | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | - | ↓ | - |
(2)写出B和E反应的离子反应方程式?Ca2++SO42-=CaSO4↓.
2.下列说法正确的是( )
| A. | 将标准状况下的2.24L CO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| B. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| C. | 0.1 mol•L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| D. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c (OH-)>c (H+)+c(HA) |