题目内容
20.硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(Mg2B205•H20、Si02及少量Fe304、CaCO3,Al2O3)为原料生产硼酸的工艺流程如图: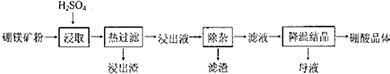
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9,7和 12.4.
(1)由于矿粉中含CaC03,“浸取”时容易产生大量泡沫使物料从反应器中溢出,故应分批加入稀硫酸.该反应的化学方程式为CaCO3 (粉末)+H2SO4=CaSO4+H2O+CO2↑.
(2)“浸出液”显酸性,含H3B03和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质.“除杂”时向浸出液中依次加入适量H202和Mg0,除去的杂质离子是Fe3+、Fe2+、Al3+.H2O2的作用是H2O2+2H++2Fe2+=2Fe3++2H2O(用离子方程式表示).
(3)已知H3B03与过量NaOH溶液反应生成Na[B(OH)4],试写出H3B03在溶液中的电离方程式:H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq).
(4)B2H6气体与水反应也可以得到硼酸,该反应的化学方程式为B2H6+6H2O=2H3BO3+6H2↑.
(5)单质硼可用于生成具有优良抗冲击性能硼钢.以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程2H3BO3+3Mg=3MgO+2B+3H2O.
分析 用硫酸浸取只有SiO2不溶,CaO转化为微溶于水的CaSO4,趁热过滤,防止H3BO3从溶液中析出,“除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,再加入MgO调节溶液的pH约为5.2,使铁离子、铝离子均转化为氢氧化铁、氢氧化铝沉淀,过滤分离,滤液经过蒸发浓缩、冷却结晶、过滤分离出H3BO3晶体.
(1)碳酸钙与硫酸反应生成硫酸根、二氧化碳与水;
(2)加适量H2O2把Fe2+氧化为Fe3+,加MgO调节溶液pH,使Fe3+、Al3+转化为沉淀而除去;
(3)H3BO3与过量NaOH溶液反应生成Na[B(OH)4],H3BO3属于一元酸,电离出[B(OH)4]-与H+;
(4)B2H6气体与水反应也可以得到硼酸,B元素化合价升高,而H元素化合价降低生成氢气;
(5)硼酸和金属镁为原料可制备单质硼,反应生成MgO、硼与水.
解答 解:用硫酸浸取只有SiO2不溶,CaO转化为微溶于水的CaSO4,趁热过滤,防止H3BO3从溶液中析出,“除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,再加入MgO调节溶液的pH约为5.2,使铁离子、铝离子均转化为氢氧化铁、氢氧化铝沉淀,过滤分离,滤液经过蒸发浓缩、冷却结晶、过滤分离出H3BO3晶体.
(1)碳酸钙与硫酸反应生成硫酸根、二氧化碳与水,反应方程式为:CaCO3 (粉末)+H2SO4=CaSO4+H2O+CO2↑,
故答案为:CaCO3 (粉末)+H2SO4=CaSO4+H2O+CO2↑;
(2)加适量H2O2把Fe2+氧化为Fe3+,反应离子方程式为:H2O2+2H++2Fe2+=2Fe3++2H2O,加MgO调节PH,使Fe3+、Al3+转化为沉淀而除去,所以除去的离子有Fe3+、Fe2+、Al3+;
故答案为:Fe3+、Fe2+、Al3+;H2O2+2H++2Fe2+=2Fe3++2H2O;
(3)H3BO3与过量NaOH溶液反应生成Na[B(OH)4],H3BO3属于一元酸,电离出[B(OH)4]-与H+,属于弱酸,电离方程式为:H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq),
故答案为:H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq);
(4)B2H6气体与水反应也可以得到硼酸,B元素化合价升高,而H元素化合价降低生成氢气,反应方程式为:B2H6+6H2O=2H3BO3+6H2↑,
故答案为:B2H6+6H2O=2H3BO3+6H2↑;
(5)硼酸和金属镁为原料可制备单质硼,反应生成MgO、硼与水,反应方程式为:2H3BO3+3Mg=3MgO+2B+3H2O,
故答案为:2H3BO3+3Mg=3MgO+2B+3H2O.
点评 本题考查物质制备方案、物质的分离提纯、对操作与试剂的分析评价、化学方程式书写等,是对学生综合能力的考查,需要学生具备扎实的基础,题目难度中等.

 寒假天地重庆出版社系列答案
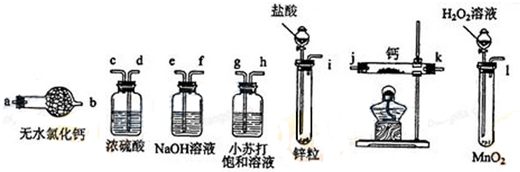
寒假天地重庆出版社系列答案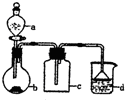 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是| 选项 | A中的物质 | b中的物质 | c中的物质 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO | H2O |
| D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 溶液中Cu2+与Fe2+的物质的量比为1:2 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 氧化性:Zn2+>Cu2+>Fe3+>Ag+ | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
| A. | 混合物:空气、矿泉水、水银 | B. | 碱:Ba(OH)2、Cu2(OH)2CO3、NH3•H2O | ||
| C. | 氧化物:H2O、CO、HCOOH | D. | 盐:苏打 醋酸钠、氯化铵 |
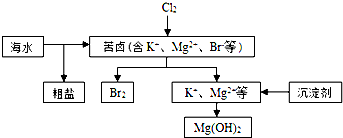
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 富集溴一般先用空气和水蒸气吹出单质溴,在用SO2将其还原吸收 | |
| D. | 工业生产中常选用NaOH作为沉淀剂 |
 .
. .
.