题目内容
1.有A、B、C、D、E、F、G七瓶不同物质的溶液,它们各是K2CO3、Na2SO4、NaCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种.为了鉴别,各取少量溶液进行两两混合,实验结果如表所示.表中“↓”表示生成沉淀或微溶化合物,“-”表示观察不到明显变化.试回答下面问题:| A | B | C | D | E | F | G | |
| A | - | - | - | - | - | - | ↓ |
| B | - | - | - | - | ↓ | ↓ | ↓ |
| C | - | - | - | ↓ | ↓ | ↓ | |
| D | - | ↓ | - | ↓ | ↓ | ↓ | |
| E | - | ↓ | - | ↓ | - | ↓ | - |
| F | - | ↓ | ↓ | ↓ | ↓ | - | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | - | ↓ | - |
(2)写出B和E反应的离子反应方程式?Ca2++SO42-=CaSO4↓.
分析 A只能和G反应生成沉淀,G能与除E外的物质反应生成沉淀,所以A是NaCl,G是AgNO3,其余物质和硝酸银不反应的只有Ca(NO3)2,所以E是Ca(NO3)2,而C与E不反应,可知C为MgCl2,F能与除A外的物质均得到沉淀,则F为Ba(OH)2,剩余的Na2SO4、K2CO3中,只能和Ca(NO3)2、Ba(OH)2、AgNO3生成沉淀的B是Na2SO4,此外可以K2CO3和AgNO3、MgCl2、Ca(NO3)2、Ba(OH)2四种物质反应生成沉淀,所以D是K2CO3.
解答 解:A只能和G反应生成沉淀,G能与除E外的物质反应生成沉淀,所以A是NaCl,G是AgNO3,其余物质和硝酸银不反应的只有Ca(NO3)2,所以E是Ca(NO3)2,而C与E不反应,可知C为MgCl2,F能与除A外的物质均得到沉淀,则F为Ba(OH)2,剩余的Na2SO4、K2CO3中,只能和Ca(NO3)2、Ba(OH)2、AgNO3生成沉淀的B是Na2SO4,此外可以K2CO3和AgNO3、MgCl2、Ca(NO3)2、Ba(OH)2四种物质反应生成沉淀,所以D是K2CO3.
(1)A的化学式是NaCl,D的化学式是K2CO3,F的化学式是Ba(OH)2,判断A理由是:相互混合时A只与G反应生成沉淀,生成的沉淀为AgCl,
故答案为:NaCl;K2CO3;Ba(OH)2;相互混合时A只与G反应生成沉淀,生成的沉淀为AgCl;
(2)B和E反应的离子反应方程式:Ca2++SO42-=CaSO4↓,故答案为:Ca2++SO42-=CaSO4↓.
点评 本题考查无机物推断,关键是根据反应现象进行判断,侧重考查学生分析推理能力,熟练掌握元素化合物性质,难度中等.

练习册系列答案
相关题目
12.向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1mol Ag.下列结论错误的是( )
| A. | 溶液中Cu2+与Fe2+的物质的量比为1:2 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 氧化性:Zn2+>Cu2+>Fe3+>Ag+ | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
9.下列有关物质的分类正确的是( )
| A. | 混合物:空气、矿泉水、水银 | B. | 碱:Ba(OH)2、Cu2(OH)2CO3、NH3•H2O | ||
| C. | 氧化物:H2O、CO、HCOOH | D. | 盐:苏打 醋酸钠、氯化铵 |
16.下列叙述正确的是( )
| A. | 加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- | |
| B. | 鉴别碳酸钠溶液和碳酸氢钠溶液,可以用稀CaCl2 溶液 | |
| C. | 做焰色反应时,每次实验要将铂丝用水洗干净,再蘸取其他物质在灯焰上灼烧 | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- |
6.下列各组混合物中,能用分液漏斗进行分离的是( )
| A. | 酒精和水 | B. | 碘和酒精 | C. | 水和CCl4 | D. | 汽油和植物油 |
13.下列关于反应能量的说法正确的是( )
| A. | 若反应A(s)=B(s);△H<O,则说明A物质比B物质稳定 | |
| B. | Zn(s)+CuSO4 (aq)═ZnSO4 (aq)+Cu(s);△H=-216kJ•mol-1.则反应物总能量<生成物总能量 | |
| C. | 101kPa时,2H2(g)+O2(g)═2H2O(l);△H=-QkJ•mol-1,则H2的燃烧热为$\frac{1}{2}$QkJ•mol-l | |
| D. | H+(aq)+OH- (aq)=H2O(l);△H=-57.3 kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
10.海水开发利用的部分过程如图所示.下列说法错误的是( )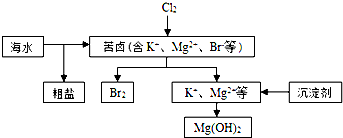

| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 富集溴一般先用空气和水蒸气吹出单质溴,在用SO2将其还原吸收 | |
| D. | 工业生产中常选用NaOH作为沉淀剂 |
11.为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了不同的方法,其中不可行的是( )
| A. | 将少量的两种白色固体分别加入1 mol/L的盐酸中,看有无气泡产生 | |
| B. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| C. | 分别取样配成溶液,滴加BaCl2溶液,观察有无白色沉淀 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
