题目内容
14.将4gNaOH和0.1mol Na2CO3混合并配成溶液,向溶液中滴加1.0mol•L-1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )| A. |  | B. | 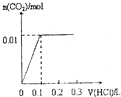 | C. | 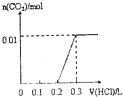 | D. |  |
分析 对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生氢氧化钠与盐酸的中和反应,再发生碳酸钠与盐酸的反应生成碳酸氢钠和氯化钠,最后发生碳酸氢钠与盐酸反应才有二氧化碳气体生成,利用物质的量的关系并结合图象即可解答.
解答 解:4gNaOH的物质的量为0.1mol和0.1mol Na2CO3混合并配成溶液,首先和NaOH反应生成水和氯化钠,当滴入到第一个格时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,当再加入到第二个格时,此步反应进行完全;继续滴加时,发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑;此时开始放出气体,正好与图象C相符,故选C.
点评 此题考查了元素化合物、图象数据的处理知识,解答此题的易错点是,不能准确理解向碳酸钠溶液中滴加盐酸的反应.是分步进行的,首先发生的是HCl+Na2CO3=NaHCO3+NaCl;进行完全后,再发生:NaHCO3+HCl=NaCl+H2O+CO2↑.

练习册系列答案
相关题目
5.实验室对下列药品的保存方法错误的是( )
| A. | 少量碳酸钙固体放在广口瓶中 | |
| B. | 少量浓硝酸放在棕色细口瓶中 | |
| C. | 少量金属钠保存在煤油中 | |
| D. | 少量氢氧化钠溶液保存在带玻璃塞的试剂瓶中 |
2.将一小块Na投入到FeCl3溶液中,可以观察到的现象是( )
| A. | 生成白色沉淀、有气体产生 | B. | 生成红褐色沉淀、有气体产生 | ||
| C. | 生成红褐色沉淀 | D. | 生成黑色沉淀、有气体产生 |
19.在2L Al2(SO4)3和(NH4)2SO4的混合溶液中加入3mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到3mol NH3,则原溶液中Al3+的浓度为( )
| A. | 0.75 mol/L | B. | 1.5 mol/L | C. | 0.25 mol/L | D. | 0.5 mol/L |
6.锰是冶炼工业中常用的添加剂.以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下,已知25℃,部分物质的溶度积常数如下:
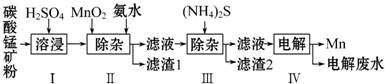
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是MnCO3+H2SO4=MnSO4+CO2↑+H2O.
(2)步骤Ⅱ中,MnO2在酸性条件下将Fe2+氧化为Fe3+,反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(3)步骤Ⅲ中,滤渣2的主要成分是CoS和NiS.
(4)步骤Ⅳ中,在阴(填“阴”或“阳”)极析出Mn,电极反应为Mn2++2e-=Mn.
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 |
| 物质 | MnS | CoS | NiS |
| Ksp | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |

(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是MnCO3+H2SO4=MnSO4+CO2↑+H2O.
(2)步骤Ⅱ中,MnO2在酸性条件下将Fe2+氧化为Fe3+,反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(3)步骤Ⅲ中,滤渣2的主要成分是CoS和NiS.
(4)步骤Ⅳ中,在阴(填“阴”或“阳”)极析出Mn,电极反应为Mn2++2e-=Mn.
4.一定量的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g),达到平衡后测得A气体的浓度为0.5mol•L-1,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为0.8mol•L-1,则下列叙述正确的是( )
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | B的物质的量浓度减小 | D. | C的体积分数降低 |

 按要求完成下列小题.
按要求完成下列小题.