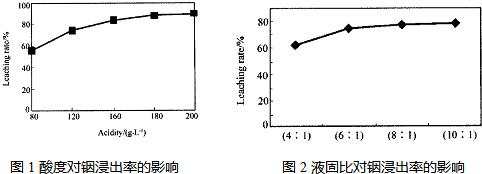
题目内容
18.在某无色澄清溶液中可能存在下列几种离子:H+、Na+、Ba2+、Fe3+、SO42-、I-、CO32-、HCO3-.取该溶液进行下列实验:①用pH试纸检验,该溶液呈强酸性;②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色;③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成.(已知氧化性:Cl2>I2)(1)根据上述实验现象,推断原溶液中肯定存在的离子是H+、Ba2+、I-,肯定不存在的离子是Fe3+、SO42-、CO32-、HCO3-,可能存在的离子是Na+.
(2)若步骤②中消耗0.02molCl2,则溶液中与Cl2反应的离子的物质的量浓度为0.2mol/L
(3)写出实验③中生成白色沉淀的离子方程式:Ba2++CO32-=BaCO3↓.
分析 无色澄清溶液不含有Fe3+,
①用pH试纸检验,该溶液呈强酸性,说明含有H+,则不含有CO32-、HCO3-;
②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色,说明含有I-;
③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成,说明含有Ba2+,则不含SO42-,以此解答该题.
解答 解:无色澄清溶液不含有Fe3+,
①用pH试纸检验,该溶液呈强酸性,说明含有H+,则不含有CO32-、HCO3-;
②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色,说明含有I-;
③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成,说明含有Ba2+,则不含SO42-,
不能确定是否含有Na+,
(1)由以上分析可知一定含有H+、Ba2+、I-,一定没有Fe3+、SO42-、CO32-、HCO3-,可能含有Na+,
故答案为:H+、Ba2+、I-;Fe3+、SO42-、CO32-、HCO3-;Na+;
(2)若步骤②中消耗0.02molCl2,发生Cl2+2I-=2Cl-+I2,则n(I-)=0.04mol,c(I-)=$\frac{0.04mol}{0.2L}$=0.2mol/L,
故答案为:0.2mol/L;
(3)实验③中生成白色沉淀的离子方程式为Ba2++CO32-=BaCO3↓,故答案为:Ba2++CO32-=BaCO3↓.
点评 本题考查了常见的离子检验方法,题目难度中等,涉及的离子之间的反应较多,注意根据有关离子间的反应和现象分析,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
9.下列化合物分子中的所有原子都处于同一平面的是( )
| A. | 甲烷 | B. | 对二甲苯 | C. | 氯乙烯 | D. | 丙烯 |
6.硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
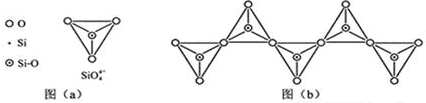
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为SiO32-.
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为SiO32-.

3.下列有机物的系统命名正确的是( )
| A. | 2-乙基戊烷 | B. | 3-甲基-2-戊烯 | C. | 2-甲基-3-戊炔 | D. | 1-甲基-5-乙基苯 |
10.邻甲基苯甲酸有多种同分异构体,其中属于酯类且分子结构中有-CH3和苯环的同分异构体有( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
8.下列表示对应化学反应的离子方程式不正确的是( )
| A. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| B. | 将过量二氧化硫气体通入氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| C. | 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO${\;}_{3}^{2-}$═CaCO3↓+SO${\;}_{3}^{2-}$ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO${\;}_{3}^{-}$═3Ag++NO↑+2H2O |
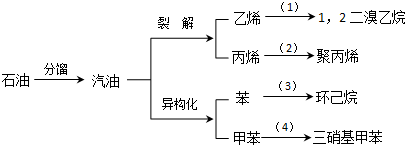
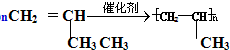 (加成聚合反应)
(加成聚合反应)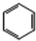 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$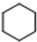 (加成反应)
(加成反应)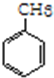 +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$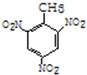 +3H2O(取代反应)
+3H2O(取代反应)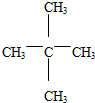 .
. .
.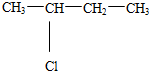 (不考虑顺反异构).
(不考虑顺反异构).