题目内容
8.A、B、C等九种物质有如框图所示转化关系.又知,A是由地壳中含量最多的金属元素形成的单质,C、D、E是常见的由短周期元素形成的气体单质,气体F与气体G相遇产生大量的白烟,H是厨房中必备一种调味剂(部分反应物和生成物及溶剂水已略去).
请回答下列问题:
(1)B的化学式为NaOH.
(2)F的电子式为
 .
.(3)写出A和B溶液反应化学方程式:2Al+2OH-+2H2O=AlO2-+3H2↑.
(4)写出E和B溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
分析 A是由地壳中含量最多的金属元素形成的单质,则A为Al,气体F与气体G相遇产生大量的白烟,分别为HCl、NH3中的一种,C、D、E是常见的由短周期元素形成的气体单质,C与D在高温高压、催化剂条件下得到F,E与D在点燃条件下得到G,可推知F为NH3、G为HCl,则D为H2、C为N2、E为Cl2,F与G反应得到I为NH4Cl,H是厨房中必备一种调味剂,A(Al)与B反应得到C(氢气),氢氧化钠与氯化铵反应得到F与H,则B为NaOH,H为NaCl.
解答 解:A是由地壳中含量最多的金属元素形成的单质,则A为Al,气体F与气体G相遇产生大量的白烟,分别为HCl、NH3中的一种,C、D、E是常见的由短周期元素形成的气体单质,C与D在高温高压、催化剂条件下得到F,E与D在点燃条件下得到G,可推知F为NH3、G为HCl,则D为H2、C为N2、E为Cl2,F与G反应得到I为NH4Cl,H是厨房中必备一种调味剂,A(Al)与B反应得到C(氢气),氢氧化钠与氯化铵反应得到F与H,则B为NaOH,H为NaCl.
(1)由上述分析可知,B的化学式为:NaOH,故答案为:NaOH;
(2)F为NH3,F的电子式为: ,故答案为:
,故答案为: ;
;
(3)A和B溶液反应的离子方程式为:2Al+2OH-+2H2O=AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=AlO2-+3H2↑;
(4)E和B溶液反应的化学方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查无机物推断,物质的含量、特殊反应是推断突破口,再结合转化关系中反应条件等进行推断,熟练掌握元素化合物性质,注意对基础知识的掌握.

练习册系列答案
相关题目
19.下列说法不正确的是( )
| A. | pH=7的溶液不一定是中性溶液 | |
| B. | 0.2 mol•L-1的盐酸与等体积水混合后pH=1(体积变化忽略不计) | |
| C. | 能自发进行的化学反应,一定是△H<0、△S>0 | |
| D. | NaNO2固体溶于水会促进水的电离(已知Ka(HNO2)=4.6×10-4) |
16.某溶液除水电离出的OH-、H+之外仅含Fe2+、Na+、Al3+、Ba2+、NO3-、SO42-、Cl-中的4种,这4种离子的物质的量均为0.1mol.若向该溶液中加入少量稀硫酸,无沉淀生成但有气泡产生.下列说法错误的是( )
| A. | 该溶液中肯定不含Ba2+ | |
| B. | 该溶液中除H+、0H-之外所含离子是Fe2+、Na+、NO3-、SO42- | |
| C. | 若向该溶液中加入过量的稀硫酸,溶液中的阴离子会减少一种 | |
| D. | 若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g固体 |
17.由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是( )
| A. | NaN3与KN3结构类似,前者晶格能较小 | |
| B. | 第一电离能(I1):N>P>S | |
| C. | 钠晶胞结构属于体心结构,该晶胞分摊含2个钠原子 | |
| D. | 氮气常温下很稳定,是因为氮的电负性小 |
18.通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热.下列是一些化学键的键能.
根据键能数据估算反应CH4+4F2=CF4+4HF每消耗1mol CH4的热效应( )
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | 放热1940 kJ | B. | 吸热1940 kJ | C. | 放热485 kJ | D. | 吸热485 kJ |
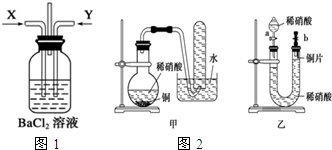 请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.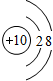 ;
;
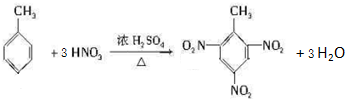 .
.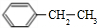 、
、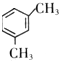 .
.